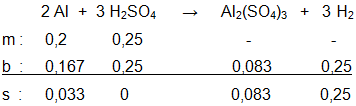Iklan
Pertanyaan
5,4 gram logam aluminium ( A r Al = 27) direaksikan dengan 24,5 gram H 2 SO 4 ( H = 1, S = 32, dan O = 16). Persamaan reaksinya: 2 Al ( s ) + 3 H 2 SO 4 ( a q ) → Al 2 ( SO 4 ) 3 ( a q ) + 3 H 2 ( g ) Tentukan: a. pereaksi pembatas b. mol pereaksi yang sisa c. volume gas H 2 pada keadaan standar (STP)
5,4 gram logam aluminium ( Al = 27) direaksikan dengan 24,5 gram ( H = 1, S = 32, dan O = 16). Persamaan reaksinya:
Tentukan:
a. pereaksi pembatas
b. mol pereaksi yang sisa
c. volume gas pada keadaan standar (STP)
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
15
4.7 (23 rating)
FJ
Ferdiansyah Junaedi
Pembahasan lengkap banget
FS
Fadila Sahdu
Makasih ❤️
ac
amandaa chelsilya
Pembahasan lengkap banget Ini yang aku cari! Bantu banget
AF
Amalia Fatillah
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia