Ana A
27 Oktober 2022 12:36
Iklan
Ana A
27 Oktober 2022 12:36
Pertanyaan
Tunjukkan dengan perubahan bilangan oksidasi unsur, apakah reaksi tergolong redoks atau bukan. 1. 2K2CrO4 + H2SO4 → K2SO4 + K2C2O7 + H2O 2. P4 + 3KOH → 3KH2PO2 + PH3
14
1
Iklan
A. Anania
Robo Expert
Mahasiswa/Alumni Hanyang University
09 November 2022 23:24
<p><strong>Jawaban yang tepat adalah (1) bukan reaksi redoks, (2) reaksi redoks. </strong></p><p><br> </p><p><strong>Reaksi reduksi merupakan reaksi yang ditandai dengan adanya peristiwa penangkapan elektron yang menyebabkan terjadinya penurunan bilangan oksidasi. Sedangkan reaksi oksidasi adalah kebalikannya, terjadi peristiwa pelepasan elektron yang menyebabkan adanya peningkatan bilangan oksidasi. Reaksi reduksi dan oksidasi ini dapat ditentukan dengan menghitung adanya perubahan bilangan oksidasi (PBO). </strong></p><p><br> </p><p><strong>Untuk menentukan apakah reaksi tersebut merupakan reaksi redoks, kita harus mencari unsur mana yang mengalami perubahan di bagian kiri dan kanan reaksi.</strong></p><p><strong>1. Pada reaksi 2K2CrO4 + H2SO4 → K2SO4 + K2Cr2O7 + H2O, yang mengalami perubahan adalah K2CrO4 menjadi K2Cr2O7, serta H2SO4 menjadi K2SO4. </strong></p><p><strong>Pada senyawa K2CrO4, bilangan oksidasi Cr adalah:</strong></p><p><strong>Biloks Cr = -((4 x biloks O) + (2x biloks K))</strong></p><p><strong>Biloks Cr = -((4x-2) + (2x1)</strong></p><p><strong>Biloks Cr = -(-6)</strong></p><p><strong>Biloks Cr = 6</strong></p><p><br> </p><p><strong>Sedangkan pada K2Cr2O7, biloks Cr adalah:</strong></p><p><strong>Biloks Cr = -(((7 x biloks O) + (2x biloks K))/2)</strong></p><p><strong>Biloks Cr = -(((7 x -2) + (2x 1))/2)</strong></p><p><strong>Biloks Cr = -((-12)/2)</strong></p><p><strong>Biloks Cr = 6</strong></p><p><br> </p><p><strong>Pada senyawa H2SO4, biloks S adalah:</strong></p><p><strong>Biloks S = -((4 x biloks O) + (2x biloks H))</strong></p><p><strong>Biloks S = -((4 x -2) + (2x 1))</strong></p><p><strong>Biloks S = -(-6)</strong></p><p><strong>Biloks S = 6</strong></p><p> </p><p> </p><p><strong>Pada senyawa K2SO4, biloks S adalah:</strong></p><p><strong>Biloks S = -((4 x biloks O) + (2x biloks K))</strong></p><p><strong>Biloks S = -((4 x -2) + (2x 1))</strong></p><p><strong>Biloks S = -(-6)</strong></p><p><strong>Biloks S = 6</strong></p><p><br> </p><p><strong>Dari biloks Cr dan S sebelum dan sesudah reaksi terlihat bahwa tidak terjadi perubahan bilangan oksidasi. Oleh karena itu, reaksi nomor 1 bukan merupakan reaksi redoks. </strong></p><p><br> </p><p><strong>Untuk lebih jelasnya dapat dilihat pada gambar berikut.</strong></p><p><br> </p><p><strong>2. Pada reaksi P4 + 3KOH → 3KH2PO2 + PH3, yang mengalami perubahan adalah P4 menjadi KH2PO2 dan P4 menjadi PH3.</strong></p><p><strong>Pada senyawa P4, biloksnya adalah 0, karena P4 merupakan senyawa bebas.</strong></p><p><br> </p><p><strong>Pada senyawa PH3, biloks P adalah:</strong></p><p><strong>Biloks P = -(3 x biloks H)</strong></p><p><strong>Biloks P = -(3 x 1)</strong></p><p><strong>Biloks P = -3</strong></p><p><br> </p><p><strong>Pada senyawa KH2PO2, biloks P adalah:</strong></p><p><strong>Biloks P = -((2 x biloks O) + (1 x biloks K) + (2 x biloks H))</strong></p><p><strong>Biloks P = -((2 x -2) + (1 x 1) + (2 x 1))</strong></p><p><strong>Biloks P = 1</strong></p><p><br> </p><p><strong>Jadi, kita dapat melihat bahwa unsur P4 mengalami reduksi dan oksidasi sekaligus menghasilkan PH3 dan KH2PO2, dimana pada senyawa PH3, biloks P turun menjadi -3, dan pada senyawa KH2PO2 biloks P naik menjadi +1. </strong></p><p><br> </p><p><strong>Untuk lebih jelasnya dapat dilihat pada gambar berikut.</strong></p><p><br> </p><p><strong>Jadi, reaksi nomor 1 bukan reaksi redoks, sedangkan reaksi nomor 2 adalah reaksi redoks.</strong></p><p><br> </p>
Jawaban yang tepat adalah (1) bukan reaksi redoks, (2) reaksi redoks.
Reaksi reduksi merupakan reaksi yang ditandai dengan adanya peristiwa penangkapan elektron yang menyebabkan terjadinya penurunan bilangan oksidasi. Sedangkan reaksi oksidasi adalah kebalikannya, terjadi peristiwa pelepasan elektron yang menyebabkan adanya peningkatan bilangan oksidasi. Reaksi reduksi dan oksidasi ini dapat ditentukan dengan menghitung adanya perubahan bilangan oksidasi (PBO).
Untuk menentukan apakah reaksi tersebut merupakan reaksi redoks, kita harus mencari unsur mana yang mengalami perubahan di bagian kiri dan kanan reaksi.
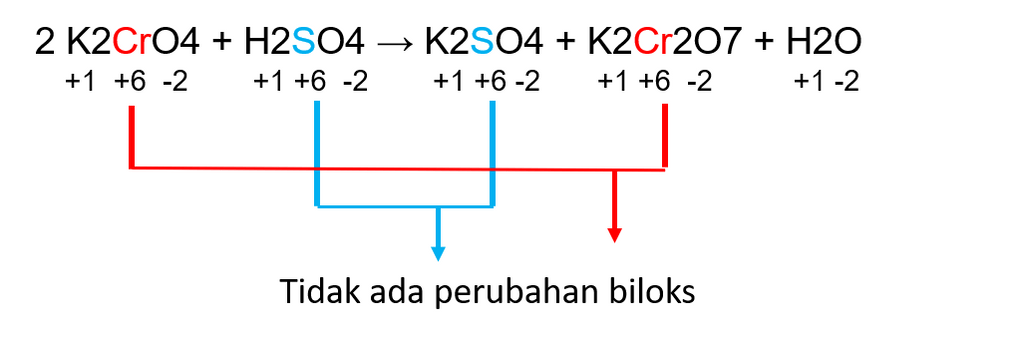
1. Pada reaksi 2K2CrO4 + H2SO4 → K2SO4 + K2Cr2O7 + H2O, yang mengalami perubahan adalah K2CrO4 menjadi K2Cr2O7, serta H2SO4 menjadi K2SO4.
Pada senyawa K2CrO4, bilangan oksidasi Cr adalah:
Biloks Cr = -((4 x biloks O) + (2x biloks K))
Biloks Cr = -((4x-2) + (2x1)
Biloks Cr = -(-6)
Biloks Cr = 6
Sedangkan pada K2Cr2O7, biloks Cr adalah:
Biloks Cr = -(((7 x biloks O) + (2x biloks K))/2)
Biloks Cr = -(((7 x -2) + (2x 1))/2)
Biloks Cr = -((-12)/2)
Biloks Cr = 6
Pada senyawa H2SO4, biloks S adalah:
Biloks S = -((4 x biloks O) + (2x biloks H))
Biloks S = -((4 x -2) + (2x 1))
Biloks S = -(-6)
Biloks S = 6
Pada senyawa K2SO4, biloks S adalah:
Biloks S = -((4 x biloks O) + (2x biloks K))
Biloks S = -((4 x -2) + (2x 1))
Biloks S = -(-6)
Biloks S = 6
Dari biloks Cr dan S sebelum dan sesudah reaksi terlihat bahwa tidak terjadi perubahan bilangan oksidasi. Oleh karena itu, reaksi nomor 1 bukan merupakan reaksi redoks.
Untuk lebih jelasnya dapat dilihat pada gambar berikut.
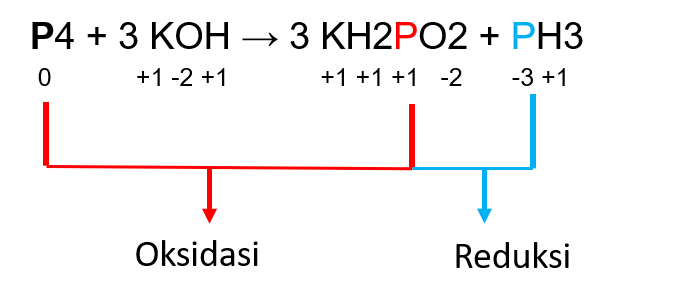
2. Pada reaksi P4 + 3KOH → 3KH2PO2 + PH3, yang mengalami perubahan adalah P4 menjadi KH2PO2 dan P4 menjadi PH3.
Pada senyawa P4, biloksnya adalah 0, karena P4 merupakan senyawa bebas.
Pada senyawa PH3, biloks P adalah:
Biloks P = -(3 x biloks H)
Biloks P = -(3 x 1)
Biloks P = -3
Pada senyawa KH2PO2, biloks P adalah:
Biloks P = -((2 x biloks O) + (1 x biloks K) + (2 x biloks H))
Biloks P = -((2 x -2) + (1 x 1) + (2 x 1))
Biloks P = 1
Jadi, kita dapat melihat bahwa unsur P4 mengalami reduksi dan oksidasi sekaligus menghasilkan PH3 dan KH2PO2, dimana pada senyawa PH3, biloks P turun menjadi -3, dan pada senyawa KH2PO2 biloks P naik menjadi +1.
Untuk lebih jelasnya dapat dilihat pada gambar berikut.
Jadi, reaksi nomor 1 bukan reaksi redoks, sedangkan reaksi nomor 2 adalah reaksi redoks.
· 0.0 (0)
Iklan
Buka akses jawaban yang telah terverifikasi

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia













