Andi M
11 Januari 2023 11:17
Iklan
Andi M
11 Januari 2023 11:17
Pertanyaan
Sebanyak 50 mL larutan H2SO4 0,005 M dicampur dengan 50 mL NaOH 0,005 M. Hitunglah pH larutan itu sebelum dan sesudah dicampurkan.
1
1
Iklan
I. Qatrunnada
Master Teacher
Mahasiswa/Alumni Univesitas Islam Indonesia
23 Juni 2023 03:41
<p>Jawaban : pH larutan NaOH dan H<sub>2</sub>SO<sub>4</sub> sebelum dicampurkan adalah 11+log 5 dan 2. Sementara pH campuran larutan adalah 3-log2,5.</p><p> </p><p>pH (Potential of Hydrogen) adalah derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki oleh suatu larutan.</p><p> </p><p>Diketahui :</p><p>V H<sub>2</sub>SO<sub>4</sub> = 50 mL</p><p>M H<sub>2</sub>SO<sub>4</sub> = 0,005 M</p><p>V NaOH = 50 mL</p><p>M NaOH = 0,005 M</p><p> </p><p>Ditanya : pH larutan sebelum dicampurkan dan pH campuran?</p><p> </p><p>Jawab :</p><p>1. Menentukan pH masing-masing larutan sebelum dicampurkan</p><ul><li>pH larutan H<sub>2</sub>SO<sub>4</sub></li></ul><p>H<sub>2</sub>SO<sub>4</sub> → 2H<sup>+</sup> + SO<sub>4</sub> <sup>2-</sup>, valensi asam = 2</p><p> </p><p>[H<sup>+</sup>] = M x valensi </p><p>[H<sup>+</sup>] = 0,005 x 2</p><p>[H<sup>+</sup>] = 10<sup>-2</sup> M</p><p> </p><p>pH = -log [H<sup>+</sup>] </p><p>pH = - log 10<sup>-2</sup></p><p>pH = 2</p><p> </p><ul><li>pH larutan NaOH</li></ul><p>NaOH → Na<sup>+</sup> + OH<sup>-</sup>, valensi basa = 1</p><p> </p><p>[OH<sup>-</sup>] = M x valensi </p><p>[OH<sup>-</sup>] = 0,005 x 1</p><p>[OH<sup>-</sup>] = 5 x 10<sup>-3</sup></p><p> </p><p>pOH = -log [OH<sup>-</sup>] </p><p>pOH = -log 5 x 10<sup>-3</sup></p><p>pOH = 3 - log 5</p><p> </p><p>pH = 14 - pOH</p><p>pH = 14 - (3-log 5)</p><p>pH = 11 + log 5</p><p> </p><p>2. Menentukan konsentrasi mula-mula dari NaOH dan H<sub>2</sub>SO<sub>4</sub> </p><p>mmol NaOH = M x V</p><p>mmol NaOH = 0,005 x 50</p><p>mmol NaOH = 0,25 mmol</p><p> </p><p>mmol H<sub>2</sub>SO<sub>4</sub> = M x V</p><p>mmol H<sub>2</sub>SO<sub>4</sub> = 0,005 x 50</p><p>mmol H<sub>2</sub>SO<sub>4</sub> = 0,25 mmol</p><p> </p><p>3. Menentukan konsentrasi yang tersisa dari campuran reaksi NaOH dan H<sub>2</sub>SO<sub>4</sub> (terlampir)</p><p> </p><p>4. Menentukan pH campuran</p><p>Dari persamaan reaksi tersebut terdapat sisa H<sub>2</sub>SO<sub>4</sub> sebanyak 0,125 mmol, maka larutan campuran tersebut bersifat asam.</p><p> </p><p>M H<sub>2</sub>SO<sub>4</sub> = mmol sisa / V total</p><p>M H<sub>2</sub>SO<sub>4</sub> = 0,125 mmol / (50+50)mL</p><p>M H<sub>2</sub>SO<sub>4</sub> = 0,125 mmol / 100 mL</p><p>M H<sub>2</sub>SO<sub>4</sub> = 1,25 x 10<sup>-3</sup></p><p> </p><p>[H<sup>+</sup>] = M x valensi </p><p>[H<sup>+</sup>] = 1,25 x 10<sup>-3</sup> x 2</p><p>[H<sup>+</sup>] = 2,5 x 10<sup>-3</sup> </p><p> </p><p>pH = -log [H<sup>+</sup>] </p><p>pH= -log 2,5 x 10<sup>-3</sup> </p><p>pH = 3 - log 2,5</p><p> </p><p>Jadi, pH larutan NaOH dan H<sub>2</sub>SO<sub>4</sub> sebelum dicampurkan adalah 11+log 5 dan 2. Sementara pH campuran larutan adalah 3-log2,5.</p>
Jawaban : pH larutan NaOH dan H2SO4 sebelum dicampurkan adalah 11+log 5 dan 2. Sementara pH campuran larutan adalah 3-log2,5.
pH (Potential of Hydrogen) adalah derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki oleh suatu larutan.
Diketahui :
V H2SO4 = 50 mL
M H2SO4 = 0,005 M
V NaOH = 50 mL
M NaOH = 0,005 M
Ditanya : pH larutan sebelum dicampurkan dan pH campuran?
Jawab :
1. Menentukan pH masing-masing larutan sebelum dicampurkan
- pH larutan H2SO4
H2SO4 → 2H+ + SO4 2-, valensi asam = 2
[H+] = M x valensi
[H+] = 0,005 x 2
[H+] = 10-2 M
pH = -log [H+]
pH = - log 10-2
pH = 2
- pH larutan NaOH
NaOH → Na+ + OH-, valensi basa = 1
[OH-] = M x valensi
[OH-] = 0,005 x 1
[OH-] = 5 x 10-3
pOH = -log [OH-]
pOH = -log 5 x 10-3
pOH = 3 - log 5
pH = 14 - pOH
pH = 14 - (3-log 5)
pH = 11 + log 5
2. Menentukan konsentrasi mula-mula dari NaOH dan H2SO4
mmol NaOH = M x V
mmol NaOH = 0,005 x 50
mmol NaOH = 0,25 mmol
mmol H2SO4 = M x V
mmol H2SO4 = 0,005 x 50
mmol H2SO4 = 0,25 mmol
3. Menentukan konsentrasi yang tersisa dari campuran reaksi NaOH dan H2SO4 (terlampir)
4. Menentukan pH campuran
Dari persamaan reaksi tersebut terdapat sisa H2SO4 sebanyak 0,125 mmol, maka larutan campuran tersebut bersifat asam.
M H2SO4 = mmol sisa / V total
M H2SO4 = 0,125 mmol / (50+50)mL
M H2SO4 = 0,125 mmol / 100 mL
M H2SO4 = 1,25 x 10-3
[H+] = M x valensi
[H+] = 1,25 x 10-3 x 2
[H+] = 2,5 x 10-3
pH = -log [H+]
pH= -log 2,5 x 10-3
pH = 3 - log 2,5
Jadi, pH larutan NaOH dan H2SO4 sebelum dicampurkan adalah 11+log 5 dan 2. Sementara pH campuran larutan adalah 3-log2,5.
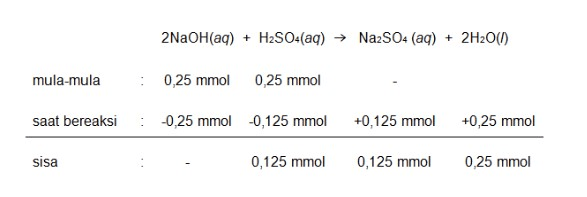
· 0.0 (0)
Iklan
Buka akses jawaban yang telah terverifikasi

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia













