RR
Rise R
21 Februari 2022 03:35
Iklan
RR
Rise R
21 Februari 2022 03:35
Pertanyaan
sebanyak 100mL larutan NH4OH 0,2 M direaksikan dengan 100 mL larutan H2SO4 0,1 M. Jika Kb NH4OH = 1×10^-5, pH larutan campuran yang terbentuk sebesar
6
1
Iklan
AA
A. Anania
Mahasiswa/Alumni Hanyang University
21 Februari 2022 13:18
Jawaban terverifikasi
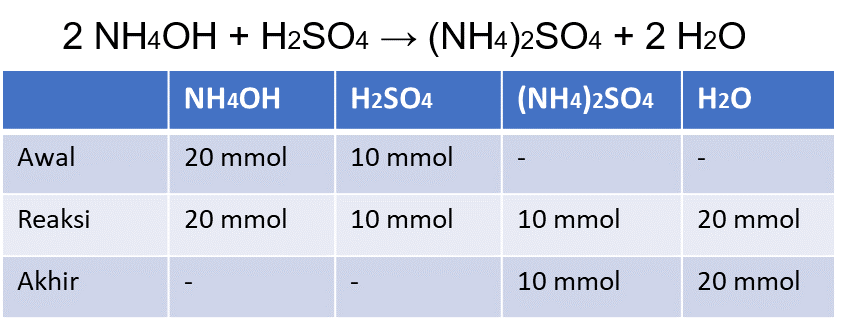
Hai Rise, kakak akan coba bantu jawab pertanyaan kamu ya. Jawaban dari pertanyaan kamu adalah 5. Pertama, kita harus mencari persamaan reaksi yang terjadi antara NH4OH dengan H2SO4, serta mencari kesetimbangan reaksinya. Reaksinya adalah sebagai berikut: 2 NH4OH + H2SO4 → (NH4)2SO4 + 2 H2O Kemudian, diketahui bahwa NH4OH yang direaksikan adalah sebanyak 100 ml 0,2 M, sedangkan H2SO4 yang direaksikan adalah sebanyak 100 ml 0,1 M. Kita dapat menghitung berapa mol NH4OH dan H2SO4 yang terdapat dalam campuran. NH4OH = 100 ml x 0,2 M = 20 mmol H2SO4 = 100 ml x 0,1 M = 10 mmol Setelah itu kita masukkan data jumlah mol NH4OH dan H2SO4 kedalam reaksi. Untuk lebih jelasnya, kamu bisa melihat tabel di gambar ya. Jadi, setelah NH4OH dan H2SO4 dicampur, maka NH4OH dan H2SO4 habis bereaksi, menghasilkan garam (NH4)2SO4 dan air. Jumlah (NH4)2SO4 dalam larutan tersebut adalah 10 mmol dalam 200 ml larutan. Garam (NH4)2SO4 adalah garam yang bersifat asam, karena (NH4)+ adalah asam konjugat kuat dan (SO4)2- adalah basa konjugat lemah. Karena itu, garam (NH4)2SO4 dapat terhidrolisis dalam air dan menghasilkan ion H+, sehingga larutan akan bersifat agak asam. (NH4)2SO4 → 2 (NH4)+ + (SO4)2- 2 NH4+ + 2 H2O ⇔ 2 NH4OH + 2 H+ (SO4)2- + H2O ≠ Selanjutnya kita dapat menghitung tetapan hidrolisis garam dari basa lemah ini dengan cara: Kh = Kw/Kb; (dimana Kh = tetapan hidrolisis, Kw = tetapan kesetimbangan air, Kb= tetapan ionisasi basa lemah) DIketahui bahwa Kb NH4OH = 1×10^-5 dan Kw = 10^-14 Kh = Kw/Kb Kh = 10^-14/10^-5 Kh = 10^-9 Kemudian kita hitung konsentrasi ion H+ dengan cara berikut: [H+] = √(Kh x [G]); (dimana Kh = tetapan hidrolisis, [G] = konsentrasi ion garam yang terhidrolisis). Konsentrasi ion garam yang terhidrolisis disini adalah konsentrasi dari NH4+. Kita dapat menghitungnya menggunakan stoikiometri reaksi hidrolisis diatas. Konsentrasi NH4+ = 2/1 x konsentrasi (NH4)2SO4 Konsentrasi NH4+ = 2/1 x 10 mmol/200 ml Konsentrasi NH4+ = 20 mmol/200 ml Konsentrasi NH4+ = 100 mmol/1000 ml Konsentrasi NH4+ = 0.1 mol/1000 ml Konsentrasi NH4+ = 0.1 M Lalu kita menghitung konsentrasi H+ dengan memasukkan rumus: [H+] = √(Kh x [G]) [H+] = √(10^-9 x 0.1) [H+] = √(10^-10) [H+] = 10^-5 Selanjutnya, kita dapat mencari pH larutan menggunakan rumus pH= -log [H+] pH = -log [H+] pH = -log (10^-5) pH = 5 Jadi, pH dari campuran 100 ml NH4OH 0,2 M dan 100 ml H2SO4 0,1 M adalah 5. Kakak harap penjelasan kakak dapat membantu kamu menyelesaikan soal ini ya. Tetap semangat! :)
· 3.0 (2)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



