Rafi R
13 Januari 2023 15:12
Iklan
Rafi R
13 Januari 2023 15:12
Pertanyaan
sebanyak 10 gram asam nitrat direaksikan dengan 11 gram amonium karbonat akan terbentuk gas yang meninggalkan larutan dan air 14 gam. massa gas yang terbentuk sebesar….gram
1
1
Iklan
Q. 'Ainillana
Mahasiswa/Alumni Universitas Negeri Yogyakarta
08 Februari 2023 04:08
<p>Massa gas yang terbentuk sebesar 3,476 gram.</p><p> </p><p>Untuk menjawab soal ini, kita tuliskan persamaan reaksi asam nitrat, HNO3 dengan amonium karbonat, (NH4)2CO3 terlebih dahulu.</p><p> </p><p>HNO<sub>3</sub> + (NH<sub>4</sub>)<sub>2</sub>CO<sub>3</sub> → NH<sub>4</sub>NO<sub>3</sub> + H<sub>2</sub>O + CO<sub>2</sub></p><p> </p><p>Gas yang dimaksud adalah gas CO2. Persamaan reaksi tersebut dapat disetarakan menjadi:</p><p> </p><p>2HNO<sub>3</sub> + (NH<sub>4</sub>)<sub>2</sub>CO<sub>3</sub> → 2NH<sub>4</sub>NO<sub>3</sub> + H<sub>2</sub>O + CO<sub>2</sub></p><p> </p><p>Melalui tabel periodik unsur, kita tentukan Mr masing-masing zat.</p><p>Ar H = 1, N = 14, O = 16, C = 12.</p><p> </p><p>Mr HNO<sub>3</sub> = 1 + 14 + (3)16 = 63 gr/mol</p><p>Mr (NH<sub>4</sub>)<sub>2</sub>CO<sub>3 </sub>= 2(14+ (4)1) + 12 + (3)16 = 96 g/mol</p><p>Mr CO<sub>2</sub> = 12 + (2)16 = 44 g/mol</p><p> </p><p>Mol mula-mula</p><p>mol HNO3 = massa / Mr</p><p>mol HNO3 = 10 g / 63 g/mol</p><p>mol HNO3 = 0,159 mol</p><p> </p><p>mol (NH<sub>4</sub>)<sub>2</sub>CO<sub>3</sub> = massa / Mr</p><p>mol (NH<sub>4</sub>)<sub>2</sub>CO<sub>3 </sub>= 11 g / 96 g/mol</p><p>mol (NH<sub>4</sub>)<sub>2</sub>CO<sub>3 </sub>= 0,115 mol</p><p> </p><p>Perbandingan mol mula-mula HNO3 dengan (NH<sub>4</sub>)<sub>2</sub>CO<sub>3</sub> tidak sesuai dengan perbandingan koefisien reaksinya, maka dibuat persamaan reaksi mbs seperti pada gambar terlampir.</p><p> </p><p>Pereaksi pembatas adalah pereaksi yang molnya habis bereaksi, yaitu HNO3. Perhatikan mol CO2 yang dihasilkan adalah 0,079 mol.</p><p> </p><p>massa CO2 = mol x Mr</p><p>massa CO2 = 0,079 mol x 44 g/mol</p><p>massa CO2 = 3,476 g</p><p> </p><p>Jadi, massa gas yang terbentuk sebesar 3,476 gram.</p>
Massa gas yang terbentuk sebesar 3,476 gram.
Untuk menjawab soal ini, kita tuliskan persamaan reaksi asam nitrat, HNO3 dengan amonium karbonat, (NH4)2CO3 terlebih dahulu.
HNO3 + (NH4)2CO3 → NH4NO3 + H2O + CO2
Gas yang dimaksud adalah gas CO2. Persamaan reaksi tersebut dapat disetarakan menjadi:
2HNO3 + (NH4)2CO3 → 2NH4NO3 + H2O + CO2
Melalui tabel periodik unsur, kita tentukan Mr masing-masing zat.
Ar H = 1, N = 14, O = 16, C = 12.
Mr HNO3 = 1 + 14 + (3)16 = 63 gr/mol
Mr (NH4)2CO3 = 2(14+ (4)1) + 12 + (3)16 = 96 g/mol
Mr CO2 = 12 + (2)16 = 44 g/mol
Mol mula-mula
mol HNO3 = massa / Mr
mol HNO3 = 10 g / 63 g/mol
mol HNO3 = 0,159 mol
mol (NH4)2CO3 = massa / Mr
mol (NH4)2CO3 = 11 g / 96 g/mol
mol (NH4)2CO3 = 0,115 mol
Perbandingan mol mula-mula HNO3 dengan (NH4)2CO3 tidak sesuai dengan perbandingan koefisien reaksinya, maka dibuat persamaan reaksi mbs seperti pada gambar terlampir.
Pereaksi pembatas adalah pereaksi yang molnya habis bereaksi, yaitu HNO3. Perhatikan mol CO2 yang dihasilkan adalah 0,079 mol.
massa CO2 = mol x Mr
massa CO2 = 0,079 mol x 44 g/mol
massa CO2 = 3,476 g
Jadi, massa gas yang terbentuk sebesar 3,476 gram.
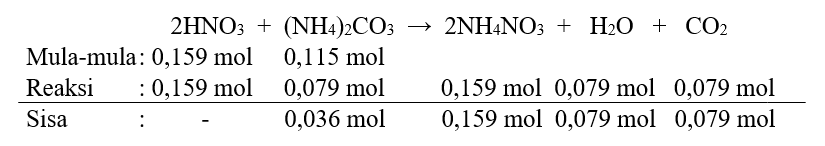
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



