SM
Syarifatul M
10 Maret 2022 13:40
Iklan
SM
Syarifatul M
10 Maret 2022 13:40
Pertanyaan
Reaksi redoks MnO2+2H2SO4+2Nal→MnSO4+Na2SO4+2H2O+12 Yang berperan sebagai reduksi dan oksidasi pada reaksi diatas adalah Penjelasan yang jelas 🙏
5
1
Iklan
DA
D. Aprilia
Master Teacher
Mahasiswa/Alumni Universitas Pendidikan Indonesia
13 Maret 2022 03:27
Jawaban terverifikasi
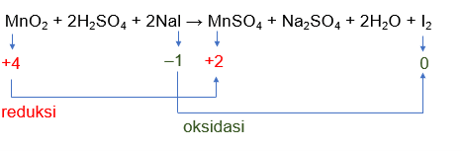
Hai Syarifatul :) Sebelumnya kakak ijin koreksi ya, persamaan reaksi yang dimaksud mungkin seperti ini MnO2 + 2H2SO4 + 2Nal → MnSO4 + Na2SO4 + 2H2O + I2 . Jadi, zat yang mengalami reduksi (oksidator) yaitu MnO2 dan zat yang mengalami oksidasi (reduktor) adalah NaI. Yuk simak penjelasannya berikut ini! Reaksi redoks merupakan reaksi antara oksidasi dan reduksi yang berlangsung secara bersamaan. Zat yang mengalami reduksi disebut oksidator, sebaliknya, zat yang mengalami oksidasi disebut reduktor. Ada beberapa konsep yang membahas mengenai redoks, salah satunya konsep redoks yang berkaitan dengan kenaikan dan penurunan bilangan oksidasi. - Reduksi = penurunan biloks - Oksidasi = kenaikan biloks Pada konsep ini, terdapat aturan-aturan dalam menentukan biloks suatu unsur, diantaranya: 1. Unsur bebas memiliki biloks = 0. 2. Biloks O berharga −2, kecuali pada senyawa peroksida H2O2, Na2O2, BaO2 biloksnya (−1), Senyawa superoksida KO2, RbO2 biloksnya (−1/2), Senyawa OF2 biloksnya (+2). 3. Jumlah total biloks atom-atom dalam senyawa netral = 0 . 4. Biloks unsur logam dalam senyawanya selalu bertanda (+) dan harganya tergantung elektron valensinya. 5. Biloks klor, brom, dan iod sama dengan -1, kecuali jika bergabung dengan unsur yang lebih elektronegatif. Pada reaksi : MnO2 + 2H2SO4 + 2Nal → MnSO4 + Na2SO4 + 2H2O + I2 Biloks Mn pada MnO2 : b.o Mn + (2×b.o O) = 0 b.o Mn + (2×(–2)) = 0 b.o Mn = +4 Pada senyawa MnSO4, ada unsur Mn , S, dan O. Agar lebih mudah, kita cari tahu dulu biloks S dari ionnya. Ion SO4 pada senyawa tersebut memiliki muatan –2 (sudah menjadi ketetapan bahwa dalam bentuk ionnya bermuatan -2 = SO4^2– ). biloks S : b.o S + (4×b.o O) = –2 b.o S + (4×(–2)) = –2 b.o S = –2 + 8 b.o S = +6 sehingga biloks Mn pada MnSO4 : b.o Mn + b.o S + (4×b.o O) = 0 b.o Mn + 6 + (4×(–2)) = 0 b.o Mn = +8 – 6 b.o Mn = +2 Mn mengalami penurunan biloks, yaitu dari +4 menjadi +2. Maka, MnO2 mengalami reduksi dan disebut sebagai oksidator. Biloks I pada NaI : b.o Na + b.o I = 0 +1 + b.o I = 0 b.o I = –1 biloks I pada I2 = 0, karena merupakan unsur bebas I mengalami kenaikan biloks, yaitu dari –1 menjadi 0, sehingga NaI mengalami reaksi oksidasi dan disebut sebagai reduktor. Untuk lebih jelasnya, perhatikan gambar dibawah.
· 0.0 (0)
Iklan
Buka akses jawaban yang telah terverifikasi

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia













