Naufan N
15 Januari 2023 08:32
Iklan
Naufan N
15 Januari 2023 08:32
Pertanyaan
reaksi di bawah ini digunakan di laboratorium untuk mendapatkan gas cl2. sebanyak 10ml larutan cr203 0,1m dan 10 ml larutan cl 0,1m dicampurkan. gas klor yang dihasilkan ditampung dalam wadah tertutup. jumlah maksimum cl2 yang dapat diperoleh dari reaksi diatas adalah...
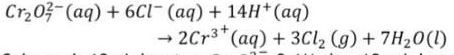
1
1
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
01 Februari 2023 04:04
<p>Jumlah maksimum Cl2 yang dapat diperoleh dari reaksi di atas adalah 0,0112 L (dalam keadaan STP).</p><p> </p><p>Perhatikan bahwa persamaan reaksi redoks tersebut telah setara, yaitu jumlah atom-atom sejenis di bagian kiri dan kanan reaksi, serta total muatan dikiri dan kanan reaksi sudah sama. Maka, perbandingan mol zat-zat yang bereaksi sebanding dengan perbandingan koefisien reaksi.</p><p> </p><p>Diketahui terdapat 10 mL larutan Cr<sub>2</sub>O<sub>7</sub><sup>2-</sup> 0,1 M dan 10 mL larutan Cl<sup>-</sup> 0,1 M, mol zat tersebut mula-mula adalah:</p><p> </p><p>mol Cr<sub>2</sub>O<sub>7</sub><sup>2-</sup> = M x V</p><p>mol Cr<sub>2</sub>O<sub>7</sub><sup>2-</sup> = 0,1 M x 10 mL </p><p>mol Cr<sub>2</sub>O<sub>7</sub><sup>2-</sup> = 1 mmol</p><p> </p><p>mol Cl- = M x V</p><p>mol Cl- = 0,1 M x 10 mL</p><p>mol Cl- = 1 mmol</p><p> </p><p>Ternyata mol zat pereaksi mula-mula tidak sebanding dengan perbandingan koefisiennya (yaitu 1 : 6), untuk itu dibuat persamaan reaksi mrs (mula-mula, reaksi, sisa) seperti pada gambar terlampir. Reaksi pembatas adalah zat pereaksi yang habis bereaksi, yaitu yang perbandingan mol dengan angka koefisiennya paling kecil, yaitu Cl-.</p><p> </p><p>Mol zat pada saat bereaksi sebanding dengan perbandingan koefisien reaksi. Maka mol Cl2 yang bereaksi adalah 0,5 mmol.</p><p> </p><p>mol Cl2 = koef Cl2 / koefisien Cl- x mol Cl-</p><p>mol Cl2 = 3 / 6 x 1 mmol</p><p>mol Cl2 = 0,5 mmol = 0,0005 mol</p><p> </p><p>Dengan demikian, jumlah maksimum Cl2 yang dapat diperoleh dari reaksi di atas adalah 0,0005 mol. Jika diukur pada keadaan standar (STP),</p><p>V (STP) = mol x 22,4 L/mol</p><p>V (STP) = 0,0005 mol x 22,4 L/mol</p><p>V (STP) = 0,0112 L</p><p> </p><p>Jadi, jumlah maksimum Cl2 yang dapat diperoleh dari reaksi di atas adalah 0,0112 L (dalam keadaan STP).</p>
Jumlah maksimum Cl2 yang dapat diperoleh dari reaksi di atas adalah 0,0112 L (dalam keadaan STP).
Perhatikan bahwa persamaan reaksi redoks tersebut telah setara, yaitu jumlah atom-atom sejenis di bagian kiri dan kanan reaksi, serta total muatan dikiri dan kanan reaksi sudah sama. Maka, perbandingan mol zat-zat yang bereaksi sebanding dengan perbandingan koefisien reaksi.
Diketahui terdapat 10 mL larutan Cr2O72- 0,1 M dan 10 mL larutan Cl- 0,1 M, mol zat tersebut mula-mula adalah:
mol Cr2O72- = M x V
mol Cr2O72- = 0,1 M x 10 mL
mol Cr2O72- = 1 mmol
mol Cl- = M x V
mol Cl- = 0,1 M x 10 mL
mol Cl- = 1 mmol
Ternyata mol zat pereaksi mula-mula tidak sebanding dengan perbandingan koefisiennya (yaitu 1 : 6), untuk itu dibuat persamaan reaksi mrs (mula-mula, reaksi, sisa) seperti pada gambar terlampir. Reaksi pembatas adalah zat pereaksi yang habis bereaksi, yaitu yang perbandingan mol dengan angka koefisiennya paling kecil, yaitu Cl-.
Mol zat pada saat bereaksi sebanding dengan perbandingan koefisien reaksi. Maka mol Cl2 yang bereaksi adalah 0,5 mmol.
mol Cl2 = koef Cl2 / koefisien Cl- x mol Cl-
mol Cl2 = 3 / 6 x 1 mmol
mol Cl2 = 0,5 mmol = 0,0005 mol
Dengan demikian, jumlah maksimum Cl2 yang dapat diperoleh dari reaksi di atas adalah 0,0005 mol. Jika diukur pada keadaan standar (STP),
V (STP) = mol x 22,4 L/mol
V (STP) = 0,0005 mol x 22,4 L/mol
V (STP) = 0,0112 L
Jadi, jumlah maksimum Cl2 yang dapat diperoleh dari reaksi di atas adalah 0,0112 L (dalam keadaan STP).
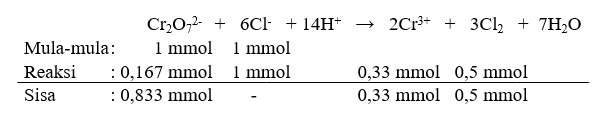
· 0.0 (0)
Iklan
Buka akses jawaban yang telah terverifikasi

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia













