Naufan N
13 Agustus 2022 08:16
Iklan
Naufan N
13 Agustus 2022 08:16
Pertanyaan
perhatikan kedua gambar larutan berikut! pernyataan yang benar mengenai kedua larutan tersebut adalah ... a. [H+] kedua larutan sama besar b. larutan HCOOH terionisas lebih banyak c. seluruh molekul NH4OH terioniasi dalam air d. kedua larutan tersebut memiliki pH yang sama e. larutan NH4OH mengubah lakmus biru menjadi merah
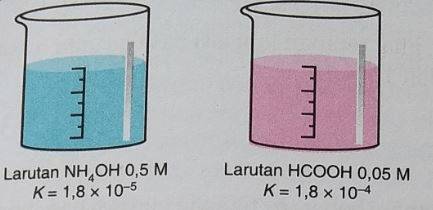
3
1
Iklan
B. Rohmawati
Mahasiswa/Alumni Universitas Negeri Semarang
28 September 2022 03:05
<p>Jawaban : B</p><p> </p><p>Senyawa basa lemah dapat dihitung besar konsentrasi ion OH- nya dengan rumus berikut.</p><p>[OH-] = √(Kb x M)</p><p>Senyawa asam lemah dapat dihitung besar konsentrasi ion H+ nya dengan rumus berikut.</p><p>[H+] = √(Ka x M)</p><p> </p><p>NH4OH tergolong ke dalam senyawa basa lemah (membirukan lakmus merah, terionisasi sebagian), sedangkan HCOOH tergolong ke dalam senyawa asam lemah (memerahkan lakmus biru, terionisasi sebagian).</p><p> </p><p>Larutan NH4OH 0,5 M, Kb = 1,8x10^-5</p><p>[OH-] = √(Kb x M)</p><p>[OH-] = √(1,8x10^-5 x 0,5 M)</p><p>[OH-] = √(9x10^-6)</p><p>[OH-] = 3x10^-3 M</p><p>pOH = 3 - log 3</p><p>pH = 11 + log 3</p><p>α = √(Kb / M)</p><p>α = √(1,8x10^-5 / 0,5 M)</p><p>α = 0,006 = 0,6%</p><p> </p><p>Larutan HCOOH 0,05 M, Kb = 1,8x10^-4</p><p>[H+] = √(Kb x M)</p><p>[H+] = √(1,8x10^-4 x 0,05 M)</p><p>[H+] = √(9x10^-6)</p><p>[H+] = 3x10^-3 M</p><p>pH = 3 - log 3</p><p>α = √(Ka / M)</p><p>α = √(1,8x10^-4 / 0,05 M)</p><p>α = 0,06 = 6%</p><p> </p><p>Jadi, pernyataan yang benar adalah larutan HCOOH terionisasi lebih banyak.</p>
Jawaban : B
Senyawa basa lemah dapat dihitung besar konsentrasi ion OH- nya dengan rumus berikut.
[OH-] = √(Kb x M)
Senyawa asam lemah dapat dihitung besar konsentrasi ion H+ nya dengan rumus berikut.
[H+] = √(Ka x M)
NH4OH tergolong ke dalam senyawa basa lemah (membirukan lakmus merah, terionisasi sebagian), sedangkan HCOOH tergolong ke dalam senyawa asam lemah (memerahkan lakmus biru, terionisasi sebagian).
Larutan NH4OH 0,5 M, Kb = 1,8x10^-5
[OH-] = √(Kb x M)
[OH-] = √(1,8x10^-5 x 0,5 M)
[OH-] = √(9x10^-6)
[OH-] = 3x10^-3 M
pOH = 3 - log 3
pH = 11 + log 3
α = √(Kb / M)
α = √(1,8x10^-5 / 0,5 M)
α = 0,006 = 0,6%
Larutan HCOOH 0,05 M, Kb = 1,8x10^-4
[H+] = √(Kb x M)
[H+] = √(1,8x10^-4 x 0,05 M)
[H+] = √(9x10^-6)
[H+] = 3x10^-3 M
pH = 3 - log 3
α = √(Ka / M)
α = √(1,8x10^-4 / 0,05 M)
α = 0,06 = 6%
Jadi, pernyataan yang benar adalah larutan HCOOH terionisasi lebih banyak.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



