SS
Skuzyy S

22 Oktober 2023 02:59
Iklan
SS
Skuzyy S

22 Oktober 2023 02:59
Pertanyaan
perhatikan diagram reaksi di bawah ini: berdasarkan diagram reaksi diatas, tuliskan persamaan reaksi termokimia untuk ∆Hf0 CO2(g)! dan tuliskan persamaan reaksi termokimia untuk ∆Hd0 CO2(g)
perhatikan diagram reaksi di bawah ini:
berdasarkan diagram reaksi diatas, tuliskan persamaan reaksi termokimia untuk ∆Hf0 CO2(g)!
dan tuliskan persamaan reaksi termokimia untuk ∆Hd0 CO2(g)

3
2
Iklan
JS
Jayahadi S
22 Oktober 2023 06:33
Jawaban terverifikasi
<p>Berdasarkan diagram tsb</p>
Berdasarkan diagram tsb
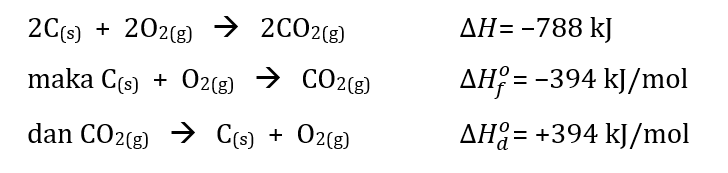
· 5.0 (1)
SS
Skuzyy S

22 Oktober 2023 12:14
okk trimakasii
Iklan
JS
J. Siregar
Mahasiswa/Alumni Universitas Negeri Medan
22 Oktober 2023 23:41
Jawaban terverifikasi
Jawaban yang benar adalah: • C(s) + O₂(g) → CO₂(g) ∆Hf° = -394 kJ • CO₂(g) → C(s) + O₂(g) ∆Hd° = 394 kJ Diagram diatas termasuk diagram tingkat energi pada termokimia. Diagram tingkat energi menunjukkan persamaan termokimia yang melibatkan perubahan entalpi setiap reaksi yang terbentuk. Jika kita perhatikan bahwa dengan menggunakan diagram tingkat energi tersebut dapat kita kaitkan juga dengan hukum Hess dimana ∆H reaksi bergantung pada kondisi awal dan akhir, bukan jumlah reaksi yang terlihat. • Perubahan entalpi reaksi pembentukan (∆Hf°) merupakan besarnya perubahan entalpi pembentukan 1 mol senyawa dari unsur-unsur pembentuknya pada kondisi standar. • Perubahan entalpi reaksi penguraian (∆Hd°) merupakan besarnya perubahan entalpi penguraian 1 mol senyawa menjadi unsur-unsur pembentuknya pada kondisi standar. Dengan kata lain, ∆Hd° merupakan kebalikan dari ∆Hf°. • Pada hukum Hess berlaku: - Jika persamaan termokimia dikali dengan suatu bilangan tertentu, maka ∆H juga dikali dengan bilangan tersebut. • Jika persamaan termokimia dibalik, maka ∆H juga akan berubah tanda. Dari data diagram tingkat energi: 2C(s) + 2O₂(g) → 2CO(g) + O₂(g) ∆H = -222 kJ (×½) 2CO(g) + O₂(g) → 2CO₂(g) ∆H = -566 kJ (×½) _________________________________ 2C(s) + 2O₂(g) → 2CO₂(g) ∆H = -788 kJ C(s) + O₂(g) → CO(g) + ½O₂(g) ∆H = -111 kJ CO(g) + ½O₂(g) → CO₂(g) ∆H = -283 kJ _________________________________ C(s) + O₂(g) → CO₂(g) ∆H = -394 kJ Berdasarkan perhitungan diatas dapat kita simpulkan bahwa ∆Hf° CO₂ = ∆H reaksi = ∆H-394 kJ/mol. Sedangkan ∆Hd° = -∆Hf° sehingga: = -(-394 kJ/mol) = 394 kJ/mol Persamaan termokimia lengkapnya menjadi: • C(s) + O₂(g) → CO₂(g) ∆Hf° = -394 kJ • CO₂(g) → C(s) + O₂(g) ∆Hd° = 394 kJ Dengan demikian, persamaan termokimianya adalah: • C(s) + O₂(g) → CO₂(g) ∆Hf° = -394 kJ • CO₂(g) → C(s) + O₂(g) ∆Hd° = 394 kJ
· 5.0 (2)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



