IN
Icha N
10 April 2022 16:05
Iklan
IN
Icha N
10 April 2022 16:05
Pertanyaan
Pada percobaan reaksi F2 + ClO2 → 2FClO2 diperoleh data: Orde reaksi terhadap ClO2 dapat ditunjukkan dengan grafik ...
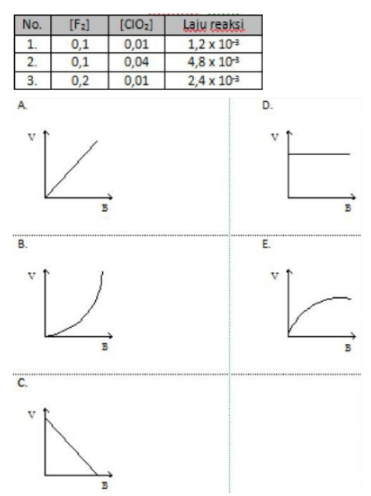
11
1
Iklan
AA
A. Atikasari
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
10 April 2022 20:42
Jawaban terverifikasi
Halo Icha, kakak bantu jawab pertanyaanmu yaa Jawaban: A. Yuk simak penjelasan berikut, agar kamu lebih paham yaa 😉 Laju reaksi adalah perubahan konsentrasi tiap satuan waktu, perubahan konsentrasi dapat berupa berkurangnya konsentrasi reaktan atau bertambahnya konsentrasi produk tiap satuan waktu. Persamaan laju reaksi dapat dituliskan sebagai berikut: v = k [A]^m[B]^n Dimana, v= Laju reaksi (mol L⁻¹ s⁻¹); k= konstanta laju reaksi; n= orde reaksi zat B; m= orde reaksi zat A. Untuk mencari orde reaksi m dan n, dapat menggunakan perhitungan berikut: >> Percobaan 1 dan Percobaan 2 saat konsentrasi F₂ tidak berubah sedangkan konsentrasi ClO₂ berubah. v₂ : v₁ = ([F₂]₂ : [F₂]₁)^m x ([ClO₂]₂ : [ClO₂]₁)^n 4,8 x 10⁻³ M/s : 1,2 x 10⁻³ M/s = (0,1 M : 0,1 M)^m x (0,04 M : 0,01 M)^n 4 = 1^m x 4^n 4 = 1 x 4^n 4 = 4^n n = 1 Orde reaksi terhadap ClO₂ adalah 1. Pada grafik laju reaksi orde satu, laju reaksi itu mempunyai perbandingan yang lurus dengan konsentrasi pereaksi. Jika konsentrasi tersebut dinaikkan dua kali, maka laju reaksi juga akan dua kali lebih cepat dari awalnya. Grafik orde 1 digambarkan oleh grafik pada opsi A. Perhatikan gambar terlampir.
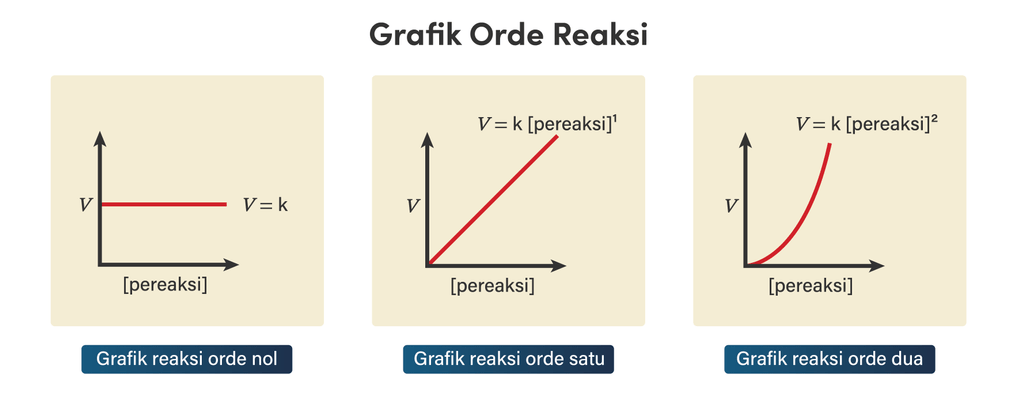
· 0.0 (0)
Iklan
Buka akses jawaban yang telah terverifikasi

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia













