SR
Santika R
03 Februari 2022 02:47
Iklan
SR
Santika R
03 Februari 2022 02:47
Pertanyaan
Diketahui bilangan kuantum elektron valensi suatu atom: n=4 ; I=2; m=-1; s=-1/2 maka konfigurasi elektron dari atom tersebut adalah... a. [Kr] 5s^2 4d^7 b. [Kr] 4d^9 c. [Kr] 5s^2 4d^2 d. [Kr] 5s^2 4d^8 e. [Kr] 5s^2 4d^1
16
1
Iklan
GS
G. Suprobo
Mahasiswa/Alumni Institut Pertanian Bogor
09 Februari 2022 01:32
Jawaban terverifikasi
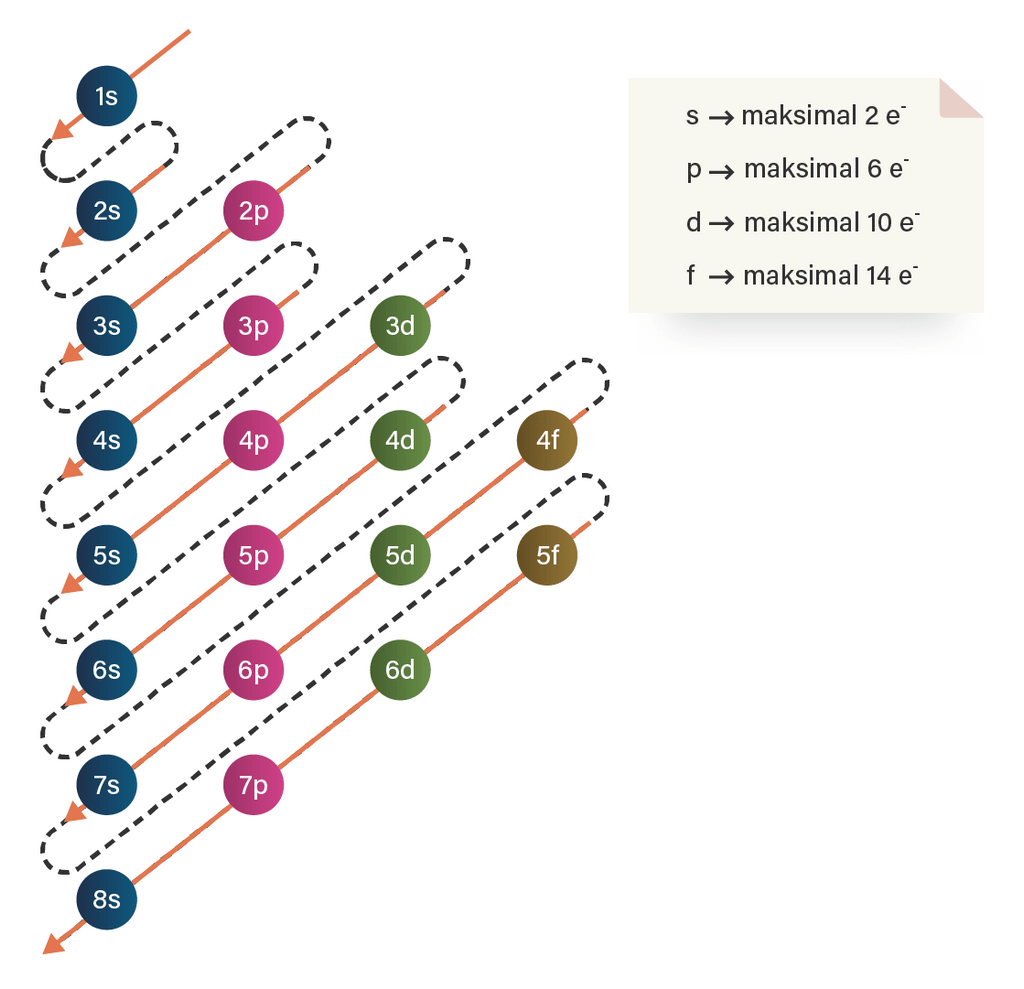
Halo Rahayu, Kakak bantu jawab ya. Jawaban dari pertanyaan di atas adalah A. Terdapat empat jenis bilangan kuantum, yaitu: 1.Bilangan kuantum utama (n), yang menunjukkan nomor kulit. Biasanya ditulis dengan angka 1, 2, 3, dst. 2.Bilangan kuantum azimuth (l), yang menunjukkan nomor subkulit. Biasanya ditulis dengan huruf s (l=0), p (l=1), d (l=2), f (l=3). 3.Bilangan kuantum magnetik (m), yang menunjukkan nomor orbital. Biasanya bernilai dari -l sampai +l. 4.Bilangan kuantum spin (s), yang menunjukkan arah elektron. Biasanya diberi tanda (+) jika arah elektron ke atas dan tanda (-) jika arah elektron ke bawah. Pada soal disajikan empat nilai bilangan kuantum unsur X yaitun=4 ; I=2; m=-1; s=-1/2. Bilangan kuantum ini dapat digunakan sebagai acuan untuk menentukan konfigurasi elektron terakhir yang nantinya akan digunakan untuk menentukan letak unsur dalam sistem periodik unsur. Berikut cara menentukan konfigurasi elektron terakhir berdasarkan bilangan kuantumnya: Bilangan kuantum n = 4 menunjukkan bahwa elektron valensi atau elektron terluar dalam ion tersebut berada pada kulit keempat. Bilangan kuantum l = 2 menunjukkan bahwa elektron valensi dari ion tersebut berada pada subkulit d. Bilangan kuantum m = -1 menunjukkan bahwa elektron valensi dari ion tersebut menempati orbital -1. Bilangan kuantum s = -1/2 menunjukkan bahwa arah elektron valensi dari ion tersebut yaitu ke bawah. Pengisian orbital elektron harus satu per satu ke arah atas terlebih dahulu. Jika sudah penuh maka diisi kembali pada orbital awal dan diisi dengan arah elektron ke bawah. Berdasarkan uraian tersebut, dapat diketahui konfigurasi elektron terakhir dari unsur tersebut adalah 4d7. Sehingga, dapat ditulis konfigurasi elektron lengkapnya dengan mengikuti aturan sebagai berikut: 1. Prinsip Aufbau (gambar terlampir) Pengisian elektron dimulai dari tingkat energi yang rendah ke tingkat energi yang tinggi. Berikut urutan tingkat energi berdasarkan Prinsip Aufbau: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p. 2. Aturan Hund Elektron menempati orbital satu persatu sebelum berpasangan. Posisinya secara tepat ditulis dalam bilangan kuantum. 3. Larangan Pauli Tidak ada dua elektron yang memiliki nilai keempat bilangan kuantum yang sama. Pengecualian subkulit d. Pada aturan ini, disebutkan jika elektron terakhir menempati subkulit s2 d4 atau s2 d9, maka penyusunan elektron dalam orbitalnya harus memenuhi aturan setengah penuh (d5) atau penuh (d10), sehingga penulisannya menjadi s1 d5 atau s1 d10. Dengan mengikuti keempat aturan tersebut, kita dapatitulis konfigurasi elektron lengkap dari unsur tersebut adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d7. Dengan demikian, konfigurasi elektron dari atom tersebut adalah [Kr] 5s^2 4d^7.
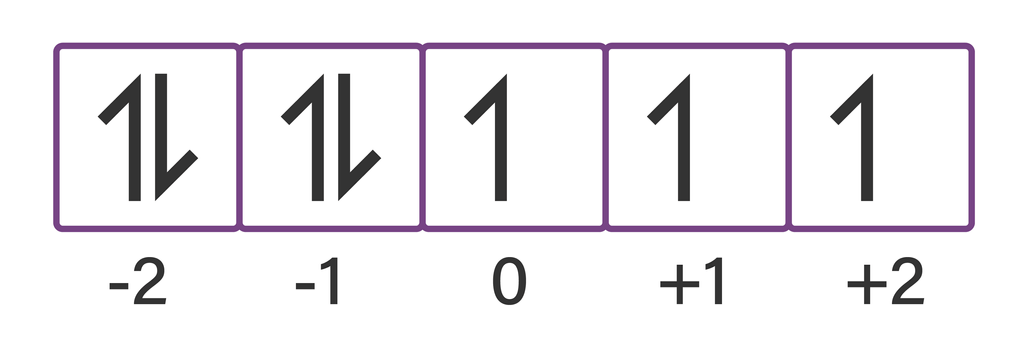
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



