Andi M
21 Juni 2022 08:31
Iklan
Andi M
21 Juni 2022 08:31
Pertanyaan
diberikan reaksi redoks berikut: H2O+ICl4^(−) →I2+IO3^(−) +Cl^(−)+H^(+) sebanyak 0,25 mol ion iICl4^(−)mengalami reaksi disproporsionasi membentuk I2 dan IO3^(−). jumlah mol elektron yang terlibat dalam reaksi redoks tersebut adalah
1
2
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
21 Juni 2022 12:29
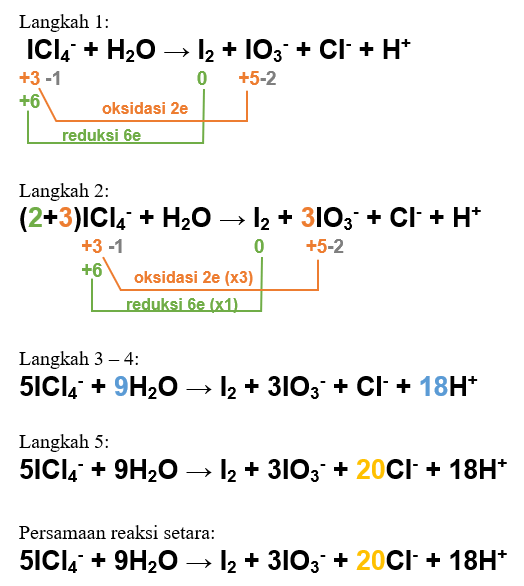
Jumlah mol elektron yang terlibat dalam reaksi redoks tersebut adalah 0,3 mol Reaksi disproporsionasi adalah reaksi redoks yang oksidator dan reduktornya merupakan zat yang sama. Untuk mengetahui jumlah mol elektron yang terlibat dalam suatu reaksi redoks, kita tentukan persamaan reaksi redoks yang setara terlebih dahulu. Salah satu cara untuk menyetarakan persamaan reaksi redoks adalah dengan metode perubahan biloks. Langkah-langkahnya adalah sebagai berikut: 1. Tentukan biloks masing-masing atom dan perubahannya. Pada reaksi tersebut, atom I (pada ICl4-) mengalami oksidasi menjadi IO3- sekaligus reduksi menjadi I2. Perhatikan biloks yang dibandingkan pada ICl4- dengan I2 adalah untu 2 atom O 2. Samakan perubahan biloks dengan cara mengali reaksi oksidasi dengan 2, sedangkan reaksi reduksi dikalikan 3. 3. Setarakan atom O dengan cara memberi koefisien H2O di bagian yang kekurangan O, maka pada reaksi tersebut ditambahkan 9 H2O di kiri reaksi. 4. Setarakan atom H dengan cara memberi koefisien pada ion H+. Ion H+ ditambahkan di kanan sebanyak 18, 5. Setarakan juga atom yang tidak mengalami perubahan biloks, yaitu Cl- dengan cara memberi koefisien 20, sehingga muatan total di kiri dan kanan juga ikut setara. Perhatikan langkah-langkah tersebut pada gambar terlampir. Pada reaksi redoks yang setara, perbandingan koefisien reaksi akan sebanding dengan perbandingan mol zat-zat yang bereaksi. Karena koefisien elektron yang terlibat pada reaksi oksidasi dan reduksi (yang sudah setara) adalah 6 elektron, maka jumlah mol elektron yang terlibat, maka: mol elektron = (koefisien elektron : koefisien ICl4-) x mol ICl4- mol elektron = (6 : 5) x 0,25 mol mol elektron = 0,3 mol Jadi, jumlah mol elektron yang terlibat dalam reaksi redoks tersebut adalah 0,3 mol.
· 0.0 (0)
Iklan
Y. Ayu
Robo Expert
21 Juni 2022 16:04
Jawaban: n e- = 0,3 mol Untuk menentukan mol elektron, maka perlu ditentukan dahulu setengah reaksinya. Penyetaraan reaksi redoks dapat disetarakan secara langsung atau menggunakan metode bilangan oksidasi dan metode setengah reaksi. Aturan penyetaraan reaksi redoks menggunakan setengah reaksi adalah sebagai berikut : 1) Menuliskan masing-masing reaksi yang mengalami reduksi dan oksidasi Reduksi : ICl4^- → I2 + Cl- Oksidasi : ICl4^- → IO3^- + Cl- 2) Menyetarakan atom selain atom O dan H Reduksi : 2ICl4^- → I2 + 8Cl- Oksidasi : ICl4^- → IO3^- + 4Cl- 3) Menambahkan H2O pada sisi yang kekurangan atom O dan menambahkan H+ pada sisi yang kekurangan H (Suasana asam) Reduksi : 2ICl4^- → I2 + 8Cl- Oksidasi : ICl4^- + 3H2O → IO3^- + 4Cl- + 6H+ 4) Menyetarakan muatan dengan menambah elektron Reduksi : 2ICl4^- + 6e- → I2 + 8Cl- Oksidasi : 3ICl4^- + 9H2O → 3IO3^- + 12Cl- + 18H+ + 6e- Reaksi setara: 5ICl4^- + 9H2O + 6e- → I2 + 3IO3^- + 20Cl- + 18H+ + 6e- Berdasarkan setengah reaksi tersebut, terdapat 6 elektron yang terlibat. Mol elektron dapat diketahui dari mol ICl4^-. n ICl4^- = 0,25 mol n e-/koefisien e- = n ICl4^-/koefisien ICl4^- n e-/6 = 0,25 mol/5 n e- = 0,3 mol Jadi, elektron yang terlibat sebanyak 0,3 mol.
· 0.0 (0)
Buka akses jawaban yang telah terverifikasi

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia













