Ana A
22 Agustus 2022 15:29
Iklan
Ana A
22 Agustus 2022 15:29
Pertanyaan
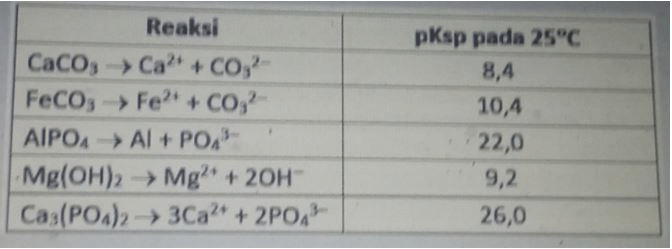
dalam pengolahan limbah anorganik, zat anorganik dapat dipisahkan dengan cara presipitasiı (pengendapan) yaitu dengan menambahkan reagen tertentu yang sesuai 8ehingga terjadi reaksi pembentukan endapan di antara zat anorganik berikut manakah yang paling mudah diendapkan ? (pksp=-logksp) a.FeCO3 b.CaCO3 c.Ca3(PO4)2 d.Mg(OH)2
1
1
Iklan
N. Izzatun
Robo Expert
Mahasiswa/Alumni Universitas Gadjah Mada
07 Oktober 2022 04:11
<p>Jawaban yang benar adalah : AlPO<sub>4 </sub>(tidak ada di opsi jawaban).</p><p> </p><p>Pembahasan :</p><p>Hasil kali kelarutan (Ksp) adalah sebuah tetapan yang didapatkan dari hasil kali konsentrasi ion-ion sukar larut dipangkatkan dengan koefisien reaksi kesetimbangan ionisasinya. Sedangkan kelarutan (s) adalah jumlah maksimum zat terlarut yang larut dalam suatu pelarut pada suhu dan tekanan tertentu. </p><p>pKsp = - log Ksp </p><p> </p><p>Kelarutan masing-masing garam : </p><p>1.) pKsp CaCO<sub>3</sub> = 8,4 </p><p>Ksp = 10<sup>-8,4</sup> = 4x10<sup>-9 </sup></p><p>Reaksi ionisasi CaCO<sub>3</sub>: </p><p>CaCO<sub>3</sub>(aq) ⇌ Ca<sup>2+</sup>(aq) + CO<sub>3</sub><sup>2-</sup>(aq) </p><p>Konsentrasi CaCO<sub>3</sub>= s, Konsentrasi Ca<sup>2+</sup>= s, Konsentrasi CO<sub>3</sub><sup>2-</sup> = s </p><p>Ksp = [Ca<sup>2+</sup>] [CO<sub>3</sub><sup>2-</sup>] </p><p>4×10<sup>-9 </sup> = (s)(s) </p><p>s = √4×10<sup>-9 </sup></p><p>s = 6x10<sup>-5</sup> mol/L </p><p> </p><p>2.) pKsp FeCO<sub>3</sub> = 10,4 </p><p>Ksp = 10<sup>-10,4</sup> = 4x10<sup>-11</sup> </p><p>Reaksi ionisasi FeCO<sub>3</sub>: </p><p>FeCO<sub>3</sub>(aq) ⇌ Fe<sup>2+</sup>(aq) + CO<sub>3</sub><sup>2-</sup>(aq) </p><p>Konsentrasi FeCO<sub>3</sub> = s, Konsentrasi Fe<sup>2+</sup> = s, Konsentrasi CO<sub>3</sub><sup>2-</sup> = s </p><p>Ksp = [Fe<sup>2+</sup>] [CO<sub>3</sub><sup>2-</sup> ] </p><p>4x10<sup>-11</sup> = (s)(s) </p><p>s = √4x10<sup>-11</sup> </p><p>s = 6x10<sup>-6 </sup>mol/L </p><p> </p><p>3.) pKsp AlPO<sub>4</sub> = 22 </p><p>Ksp = 10<sup>-22 </sup></p><p>Reaksi ionisasi AlPO<sub>4 </sub>: </p><p>AlPO<sub>4</sub>(aq) ⇌ Al<sup>3+</sup>(aq) + PO<sub>4</sub><sup>3-</sup>(aq) </p><p>Konsentrasi AlPO<sub>4</sub> = s, Konsentrasi Al<sup>3+</sup> = s, Konsentrasi PO<sub>4</sub><sup>3-</sup> = s </p><p>Ksp = [Al<sup>3+</sup>] [PO<sub>4</sub><sup>3-</sup>] </p><p>10<sup>-22 </sup> = (s)(s) </p><p>s = √10<sup>-22 </sup></p><p>s = 10<sup>-11</sup> mol/L </p><p> </p><p>4.) pKsp Mg(OH)<sub>2 </sub>= 9,2 </p><p>Ksp Mg(OH)<sub>2</sub> = 10<sup>-9,2</sup> = 6x10<sup>-10</sup> </p><p>Reaksi ionisasi Mg(OH)<sub>2</sub>: </p><p>Mg(OH)<sub>2</sub>(aq) ⇌ Mg<sup>2+</sup>(aq) + 2OH<sup>-</sup>(aq) </p><p>Konsentrasi Mg(OH)<sub>2</sub> = s, Konsentrasi Mg<sup>2+</sup> = s, Konsentrasi OH<sup>-</sup> = 2s </p><p>Ksp = [Mg<sup>2+</sup>] [OH<sup>-</sup>]<sup>2</sup> </p><p>6x10<sup>-10</sup> = (s)x(2s)<sup>2</sup> </p><p>4s<sup>3</sup> = 6x10<sup>-10</sup> </p><p>s = ∛1,5×10<sup>-10</sup> </p><p>s = 5,3 x 10<sup>-4</sup> mol/L </p><p> </p><p>5.) pKsp Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2 </sub>= 26 </p><p>Ksp Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub> = 10<sup>-26</sup> </p><p>Reaksi ionisasi Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2 </sub>: </p><p>Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub>(aq) ⇌ 3Ca<sup>2+</sup>(aq) + 2PO<sub>4</sub><sup>3-</sup>(aq) </p><p>Konsentrasi Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2 </sub>= s, Konsentrasi Ca<sup>2+</sup> = 3s, Konsentrasi PO<sub>4</sub><sup>3- </sup>= 2s </p><p>Ksp = [Ca<sup>2+</sup>]<sup>3</sup> [PO<sub>4</sub><sup>3-</sup>]<sup>2</sup> </p><p>10<sup>-26</sup> = (3s)<sup>3</sup> x (2s)<sup>2</sup> </p><p>108s<sup>5</sup> = 10<sup>-26</sup> </p><p>s = (92,5 × 10<sup>-30</sup>)<sup>0,2</sup> </p><p>s = 2,5 x 10<sup>-6</sup> mol/L </p><p> </p><p>Semakin kecil kelarutan suatu zat, maka semakin mudah diendapkan. Kelarutan yang paling kecil dimiliki oleh AlPO<sub>4</sub>, sehingga AlPO<sub>4 </sub>paling mudah diendapkan. </p><p> </p><p>Jadi, garam yang paling mudah diendapkan adalah AlPO<sub>4</sub>.</p>
Jawaban yang benar adalah : AlPO4 (tidak ada di opsi jawaban).
Pembahasan :
Hasil kali kelarutan (Ksp) adalah sebuah tetapan yang didapatkan dari hasil kali konsentrasi ion-ion sukar larut dipangkatkan dengan koefisien reaksi kesetimbangan ionisasinya. Sedangkan kelarutan (s) adalah jumlah maksimum zat terlarut yang larut dalam suatu pelarut pada suhu dan tekanan tertentu.
pKsp = - log Ksp
Kelarutan masing-masing garam :
1.) pKsp CaCO3 = 8,4
Ksp = 10-8,4 = 4x10-9
Reaksi ionisasi CaCO3:
CaCO3(aq) ⇌ Ca2+(aq) + CO32-(aq)
Konsentrasi CaCO3= s, Konsentrasi Ca2+= s, Konsentrasi CO32- = s
Ksp = [Ca2+] [CO32-]
4×10-9 = (s)(s)
s = √4×10-9
s = 6x10-5 mol/L
2.) pKsp FeCO3 = 10,4
Ksp = 10-10,4 = 4x10-11
Reaksi ionisasi FeCO3:
FeCO3(aq) ⇌ Fe2+(aq) + CO32-(aq)
Konsentrasi FeCO3 = s, Konsentrasi Fe2+ = s, Konsentrasi CO32- = s
Ksp = [Fe2+] [CO32- ]
4x10-11 = (s)(s)
s = √4x10-11
s = 6x10-6 mol/L
3.) pKsp AlPO4 = 22
Ksp = 10-22
Reaksi ionisasi AlPO4 :
AlPO4(aq) ⇌ Al3+(aq) + PO43-(aq)
Konsentrasi AlPO4 = s, Konsentrasi Al3+ = s, Konsentrasi PO43- = s
Ksp = [Al3+] [PO43-]
10-22 = (s)(s)
s = √10-22
s = 10-11 mol/L
4.) pKsp Mg(OH)2 = 9,2
Ksp Mg(OH)2 = 10-9,2 = 6x10-10
Reaksi ionisasi Mg(OH)2:
Mg(OH)2(aq) ⇌ Mg2+(aq) + 2OH-(aq)
Konsentrasi Mg(OH)2 = s, Konsentrasi Mg2+ = s, Konsentrasi OH- = 2s
Ksp = [Mg2+] [OH-]2
6x10-10 = (s)x(2s)2
4s3 = 6x10-10
s = ∛1,5×10-10
s = 5,3 x 10-4 mol/L
5.) pKsp Ca3(PO4)2 = 26
Ksp Ca3(PO4)2 = 10-26
Reaksi ionisasi Ca3(PO4)2 :
Ca3(PO4)2(aq) ⇌ 3Ca2+(aq) + 2PO43-(aq)
Konsentrasi Ca3(PO4)2 = s, Konsentrasi Ca2+ = 3s, Konsentrasi PO43- = 2s
Ksp = [Ca2+]3 [PO43-]2
10-26 = (3s)3 x (2s)2
108s5 = 10-26
s = (92,5 × 10-30)0,2
s = 2,5 x 10-6 mol/L
Semakin kecil kelarutan suatu zat, maka semakin mudah diendapkan. Kelarutan yang paling kecil dimiliki oleh AlPO4, sehingga AlPO4 paling mudah diendapkan.
Jadi, garam yang paling mudah diendapkan adalah AlPO4.
· 0.0 (0)
Iklan
Buka akses jawaban yang telah terverifikasi

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia













