Sabira I
29 Juli 2025 11:59
Iklan
Sabira I
29 Juli 2025 11:59
Pertanyaan
bantu jawab
bantu jawab

8
1
Iklan
Patrick H
29 Juli 2025 13:54
<p>Kita punya persamaan reaksi:</p><p>Al(<i>s</i>) + H<sub>2</sub>SO<sub>4</sub>(<i>aq</i>) --> Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>(<i>aq</i>) + H<sub>2</sub>(<i>g</i>)</p><p>Perhatikan bahwa persamaan reaksi tersebut belum setara, maka perlu kita setarakan dulu menjadi:</p><p>2Al(<i>s</i>) + 3H<sub>2</sub>SO<sub>4</sub>(<i>aq</i>) --> Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>(<i>aq</i>) + 3H<sub>2</sub>(<i>g</i>)</p><p> </p><p>*Dari tabel periodik, diperoleh massa molar Al = 27 g/mol dan S = 32 g/mol. Maka, massa molar masing-masing reaktan adalah:</p><p>Ar Al = 27 g/mol.</p><p>Mr H<sub>2</sub>SO<sub>4</sub> = 2×1 g/mol + 32 g/mol + 4×16 g/mol = 98 g/mol.</p><p> </p><p>Jumlah mula-mula tiap pereaksi:</p><p>mol Al = 10,8 g / 27 g/mol = 0,4 mol.</p><p>mol H<sub>2</sub>SO<sub>4</sub> = 49 g / 98 g/mol = 0,5 mol.</p><p> </p><p><strong>a. Mencari pereaksi pembatas</strong></p><p>Cara standarnya adalah dengan menghitung rasio mol terhadap koefisien reaksi dari masing-masing reaktan. Reaktan yang memiliki nilai rasio yang paling kecil adalah reaktan pembatas.</p><p>rasio mol Al = 0,4 / 2 = 0,2</p><p>rasio mol H<sub>2</sub>SO<sub>4</sub> = 0,5 / 3 ≈ 0,167</p><p>Maka, pereaksi pembatasnya adalah <strong>H<sub>2</sub>SO<sub>4</sub></strong>.</p><p> </p><p><strong>b. Menghitung jumlah sisa tiap reaktan</strong></p><p>Karena H<sub>2</sub>SO<sub>4</sub> adalah pereaksi pembatas, maka <strong>H<sub>2</sub>SO<sub>4</sub> habis bereaksi (tak bersisa)</strong>.</p><p>Sementara itu, jumlah mol Al yang bereaksi adalah:</p><p>2/3 × 0,5 mol = 1/3 mol ≈ 0,33 mol.</p><p>Sehingga, <strong>sisa mol Al = 0,4 - 0,33 = 0,067 mol</strong>.</p><p> </p><p><strong>c. Menghitung volume gas H<sub>2</sub> pada keadaan STP</strong></p><p>Perbandingan koefisien reaksi H<sub>2</sub>SO<sub>4</sub> dan H<sub>2</sub> adalah 1:1, sehingga jumlah mol H<sub>2</sub> yang dihasilkan = jumlah mol H<sub>2</sub>SO<sub>4</sub> yang bereaksi = 0,5 mol.</p><p>Pada kondisi STP, tiap 1 mol gas mengisi volume 22,4 L.</p><p>Maka volume gas H<sub>2</sub> = 0,5 × 22,4 = <strong>11,2 L</strong>.</p>
Kita punya persamaan reaksi:
Al(s) + H2SO4(aq) --> Al2(SO4)3(aq) + H2(g)
Perhatikan bahwa persamaan reaksi tersebut belum setara, maka perlu kita setarakan dulu menjadi:
2Al(s) + 3H2SO4(aq) --> Al2(SO4)3(aq) + 3H2(g)
*Dari tabel periodik, diperoleh massa molar Al = 27 g/mol dan S = 32 g/mol. Maka, massa molar masing-masing reaktan adalah:
Ar Al = 27 g/mol.
Mr H2SO4 = 2×1 g/mol + 32 g/mol + 4×16 g/mol = 98 g/mol.
Jumlah mula-mula tiap pereaksi:
mol Al = 10,8 g / 27 g/mol = 0,4 mol.
mol H2SO4 = 49 g / 98 g/mol = 0,5 mol.
a. Mencari pereaksi pembatas
Cara standarnya adalah dengan menghitung rasio mol terhadap koefisien reaksi dari masing-masing reaktan. Reaktan yang memiliki nilai rasio yang paling kecil adalah reaktan pembatas.
rasio mol Al = 0,4 / 2 = 0,2
rasio mol H2SO4 = 0,5 / 3 ≈ 0,167
Maka, pereaksi pembatasnya adalah H2SO4.
b. Menghitung jumlah sisa tiap reaktan
Karena H2SO4 adalah pereaksi pembatas, maka H2SO4 habis bereaksi (tak bersisa).
Sementara itu, jumlah mol Al yang bereaksi adalah:
2/3 × 0,5 mol = 1/3 mol ≈ 0,33 mol.
Sehingga, sisa mol Al = 0,4 - 0,33 = 0,067 mol.
c. Menghitung volume gas H2 pada keadaan STP
Perbandingan koefisien reaksi H2SO4 dan H2 adalah 1:1, sehingga jumlah mol H2 yang dihasilkan = jumlah mol H2SO4 yang bereaksi = 0,5 mol.
Pada kondisi STP, tiap 1 mol gas mengisi volume 22,4 L.
Maka volume gas H2 = 0,5 × 22,4 = 11,2 L.
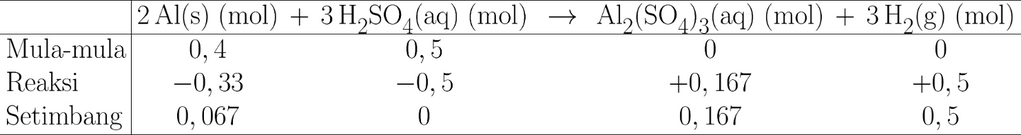
· 5.0 (1)
Iklan
Mau jawaban yang terverifikasi?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



