AM
Andi M
27 Juni 2022 09:05
Iklan
AM
Andi M
27 Juni 2022 09:05
Pertanyaan
atom 33I dapat membentuk beberapa senyawa dengan atom 17Cl. spesi berikut yang bersifat nonpolar adalah .... a. ICl3 b. ICl4- c. ICl4+ d. ICl3 dan ICl4- e. ICl3 dan ICl4+
2
1
Iklan
NI
N. Izzatun
Mahasiswa/Alumni Universitas Gadjah Mada
27 Juni 2022 11:54
Jawaban terverifikasi
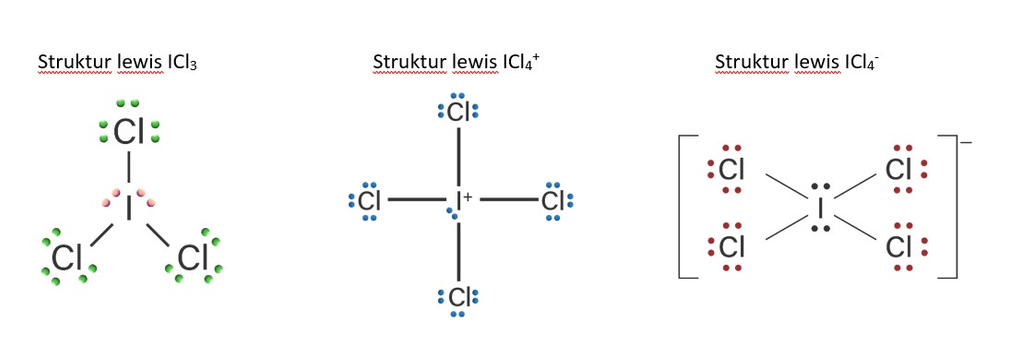
Jawabannya : b. ICl4- Pembahasan : Sebelumnya kita koreksi dulu ya, yang benar "53I" bukan 33I, karena nomor atom I adalah 53. Bentuk molekul menentukan sifat kepolaran senyawa kovalen. Jika di dalam molekul terdapat pemisahan muatan maka kerapatan elektron dalam molekul tidak merata sehingga molekul bersifat polar. Sebaliknya, jika kerapatan elektron tersebar merata maka molekul bersifat nonpolar. Senyawa kovalen akan bersifat nonpolar jika molekulnya berbentuk simetris, sedangkan senyawa kovalen akan bersifat polar jika pada atom pusat dari molekul senyawa tersebut terdapat pasangan elektron bebas (PEB) sehingga bentuk molekulnya menjadi tidak simetris. Pada soal tersebut, spesi yang dapat dibentuk dari atom 53I dan 17Cl adalah senyawa ICl3, kation ICl4+, dan anion ICl4-. --> perhatikan struktur Lewisnya pada gambar terlampir. Berdasarkan struktur Lewis, 1. Pada senyawa ICl3, terdapat 2 buah pasangan elektron bebas (PEB) dan 3 buah pasangan elektron berikatan (PEI). 2. Pada kation ICl4+, atom I melepaskan 1 buah elektronnya, sehingga hanya terdapat 6 buah elektron pada atom I kemudian 4 buah elektronnya digunakan untuk berikatan dengan 4 buah atom Cl sebagai PEI dan 2 buah elektron sisanya menjadi 1 buah PEB. 3. Pada anion ICl4-, atom I mengikat 1 buah elektron, sehingga terdapat 8 buah elektron dimiliki atom I kemudian 4 buah elektronnya digunakan untuk berikatan dengan 4 buah atom Cl sebagai PEI dan 4 buah elektron sisanya menjadi 2 buah PEB. Sebelum menentukan bentuk molekul dan sifat kepolarannya, perlu ditentukan terlebih dahulu tipe molekulnya dengan notasi A,X, dan E, dimana A sebagai atom pusat, X sebagai pasangan elektron berikatan (PEI), dan E merupakan pasangan elektron bebas (PEB). 1. Pada senyawa ICl3, terdapat 2 buah PEB dan 3 buah PEI, maka tipe molekulnya adalah AX3E2, bentuk molekulnya yaitu bentuk T. 2. Pada kation ICl4+, terdapat 1 buah PEB dan 4 buah PEI, maka tipe molekulnya adalah AX4E, bentuk molekulnya yaitu tetrahedral terdistorsi atau bentuk jungkat jungkit. 3. Pada anion ICl4-, terdapat 2 buah PEB dan 4 buah PEI, maka tipe molekulnya adalah AX4E2, bentuk molekulnya yaitu segi empat planar. Diantara ketiga bentuk molekul di atas, yang menunjukkan senyawa nonpolar adalah bentuk segi empat planar yang dimiliki oleh anion ICl4-. Hal ini disebabkan karena kerapatan elektronnya tersebar merata sehingga bentuk molekulnya menjadi simetris. Jadi, spesi yang bersifat nonpolar adalah anion ICl4- (jawaban b)
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



