YY
Yolamnda Y
15 Januari 2023 05:49
Iklan
YY
Yolamnda Y
15 Januari 2023 05:49
Pertanyaan
100 mL asam lemah HX 0,1 M direaksikan dengan 100 mL NH4OH 0,1 M menghasilkan larutan dengan pH 9,5. Bila harga Kb NH3 = 10^-5, harga Ka HX adalah .... a. 1 b. 10^-4 c. 10^-5 d. 10^-9 e. 10^-10
1
1
Iklan
SZ
S. Zulaihah
Robo Expert
Mahasiswa/Alumni Universitas Negeri Surabaya
07 Februari 2023 12:17
Jawaban terverifikasi
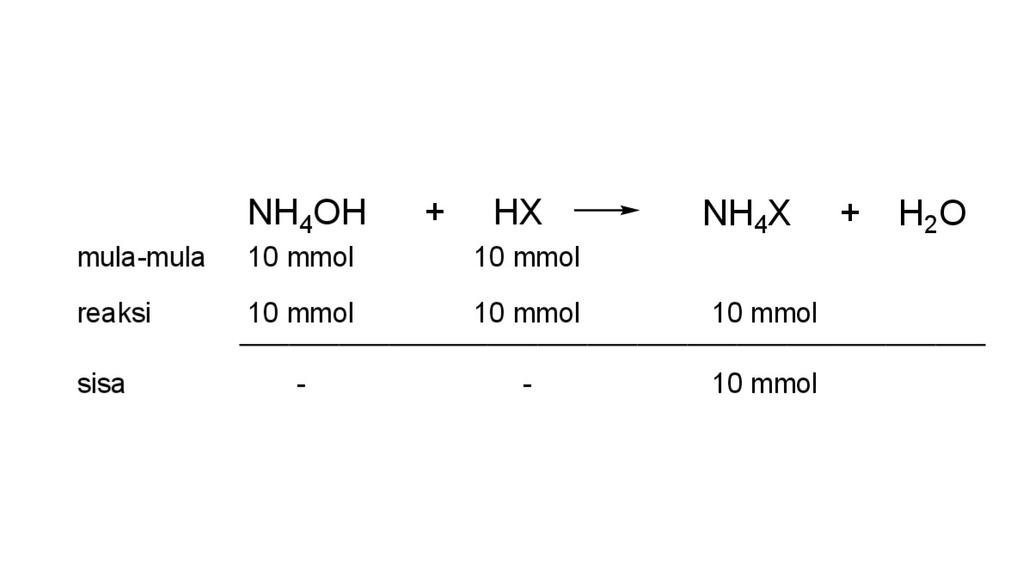
Jawaban yang benar adalah E. 10⁻¹⁰ Jika suatu asam lemah bereaksi dengan basa lemah dan keduanya habis bereaksi maka akan terjadi hidrolisis total. [H⁺] = √((Kw×Ka) / Kb) ▪︎ menentukan mol HX dan mol NH4OH mol HX = M × V mol HX = 0,1 M × 100 ml mol HX = 10 mmol mol NH4OH = M × V mol NH4OH = 0,1 M × 100 ml mol NH4OH = 10 mmol ▪︎ menentukan nilai Ka pH = 9,5 [H⁺] = 10^-9,5 M [H⁺] = √((Kw×Ka) / Kb) 10^-9,5 M = √((10⁻¹⁴ × Ka) / 10⁻⁵) 10⁻¹⁹ M = (10⁻¹⁴ × Ka) / 10⁻⁵ Ka = 10⁻¹⁰ Jadi, jawaban yang benar adalah E.
· 0.0 (0)
Iklan
Buka akses jawaban yang telah terverifikasi

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia













