Iklan
Pertanyaan
Zat R dapat bereaksi membentuk produk P1 atau produk P2. Profil reaksi untuk dua reaksi tersebut ditunjukkan di bawah ini. Dibandingkan dengan reaksi R → P 1 , reaksi R → P 2 adalah ....
Zat R dapat bereaksi membentuk produk P1 atau produk P2. Profil reaksi untuk dua reaksi tersebut ditunjukkan di bawah ini.
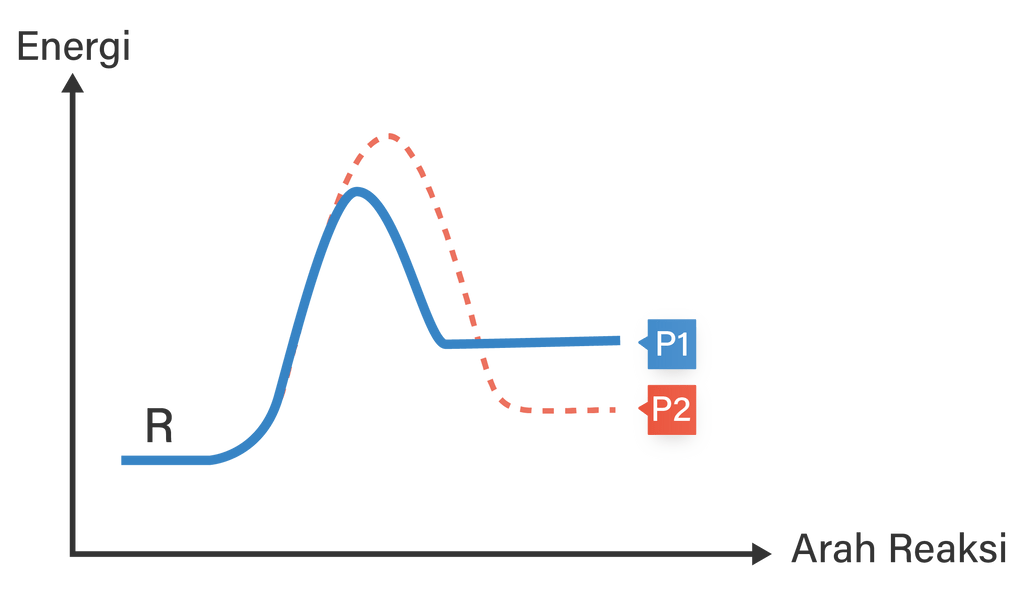
Dibandingkan dengan reaksi , reaksi adalah ....
lebih cepat dan kurang endotermik
lebih cepat dan sangat endotermik
lebih cepat dan lebih endotermik
lebih lambat dan kurang endotermik
lebih lambat dan lebih endotermik
Iklan
PO
P. Osara
Master Teacher
Jawaban terverifikasi
1
5.0 (3 rating)
mP
melsina Putirulan
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















