Iklan
Pertanyaan
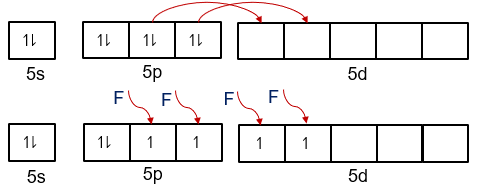
Unsur Xe merupakan golongan gas mulia yang sukar berikatan dengan unsur lain. Namun, seiring berkembangnya teknologi, ternyata dapat dibuat senyawa dari unsur dengan unsur paling elektronegatif F yaitu XeF 4 . Tentukan bentuk geometri dan tipe hibridisasi pada molekul (NA = 54, = 9).
Unsur merupakan golongan gas mulia yang sukar berikatan dengan unsur lain. Namun, seiring berkembangnya teknologi, ternyata dapat dibuat senyawa dari unsur dengan unsur paling elektronegatif yaitu . Tentukan bentuk geometri dan tipe hibridisasi pada molekul
(NA
= 54,
= 9).
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
18
4.7 (14 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia