Konfigurasi elektron merupakan cara penyusunan elektron dalam suatu atom. Konfigurasi elektron menggunakan cara per subkulit (s, p, d, f) mengikuti aturan Aufbau. Kata Aufbau berasal dari bahasa Jerman yang berarti meningkat. Aturan Aufbau menyatakan bahwa elektron menempati orbital secara bertahap dimulai dari yang berenergi paling rendah. Setelah orbital berenergi rendah terisi penuh, elektron menempati orbital yang energinya satu tingkat lebih tinggi dan seterusnya sampai semua elektron dalam atom menempati orbitalnya.
Berdasarkan jumlah energi yang dimiliki setiap orbital, urutan pengisian orbital oleh elektron menurut aturan Aufbau dapat digambarkan pada diagram sebagai berikut.
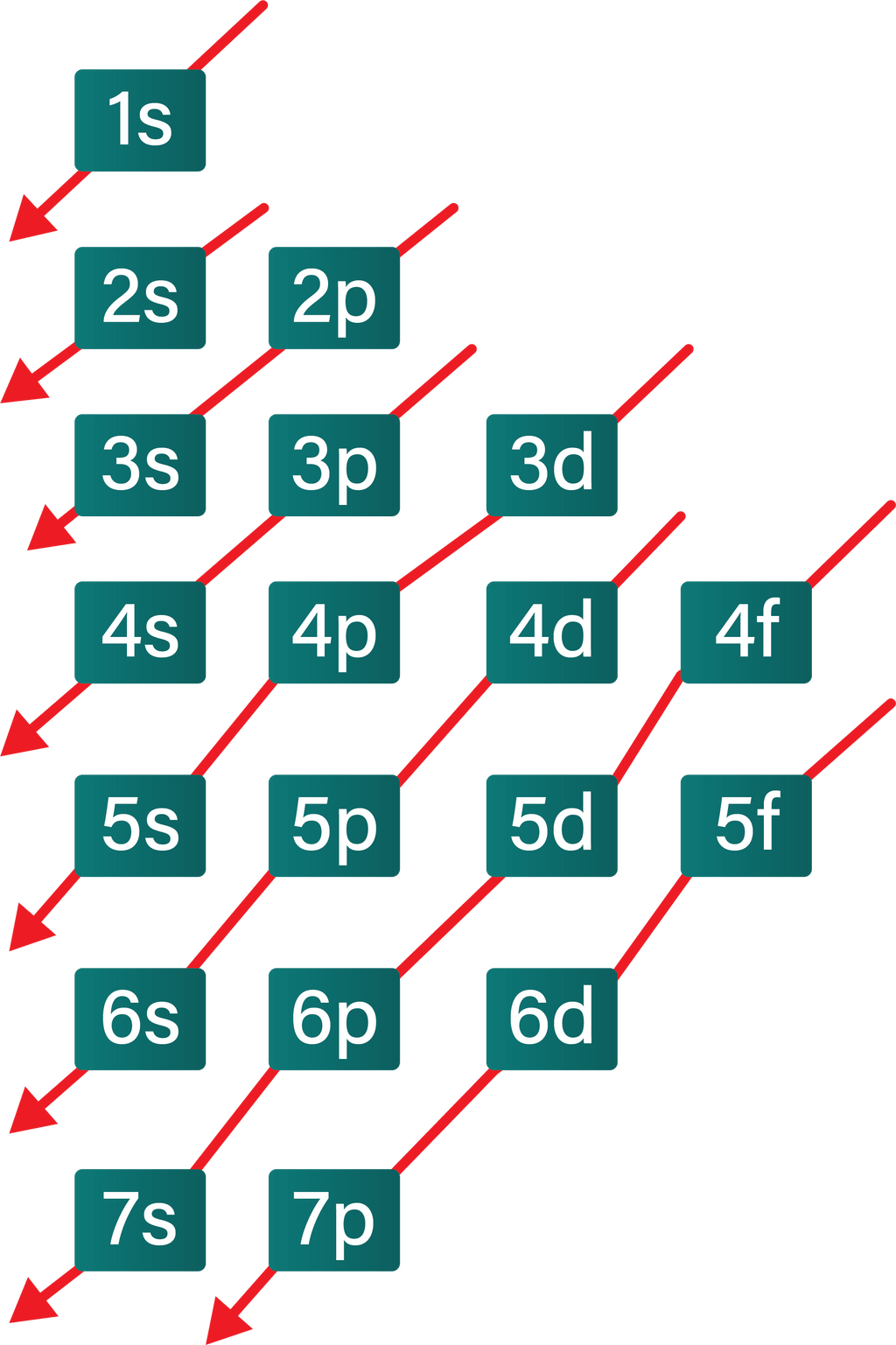
Berdasarkan diagram tersebut, pengisian elektron dalam suatu atom disusun berdasarkan urutan 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, dan 7p. Orbital s dapat diisi maksimal 2 elektron, orbital p dapat diisi maksimal 6 elektron, orbital d dapat diisi maksimal 10 elektron, dan orbital f maksimal dapat diisi 14 elektron.
Atom 1939K memiliki nomor atom = 19, dan nomor massa = 39. Nomor atom menunjukkan jumlah proton yang terdapat dalam suatu atom, karena atom 1939K merupakan atom netral, maka jumlah protonnya = jumlah elektron. Nomor massa menunjukkan jumlah proton dan neutron dalam inti atom tersebut. Dengan mengikuti kaidah pengisian elektron dari Aufbau, maka konfigurasi elektron dari atom 1939K adalah sebagai berikut.
19K=1s2 2s2 2p6 3s2 3p6 4s1
Dengan demikian, maka unsur 1939K mempunyai konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 4s1.
Jadi, jawaban yang tepat adalah B.
















