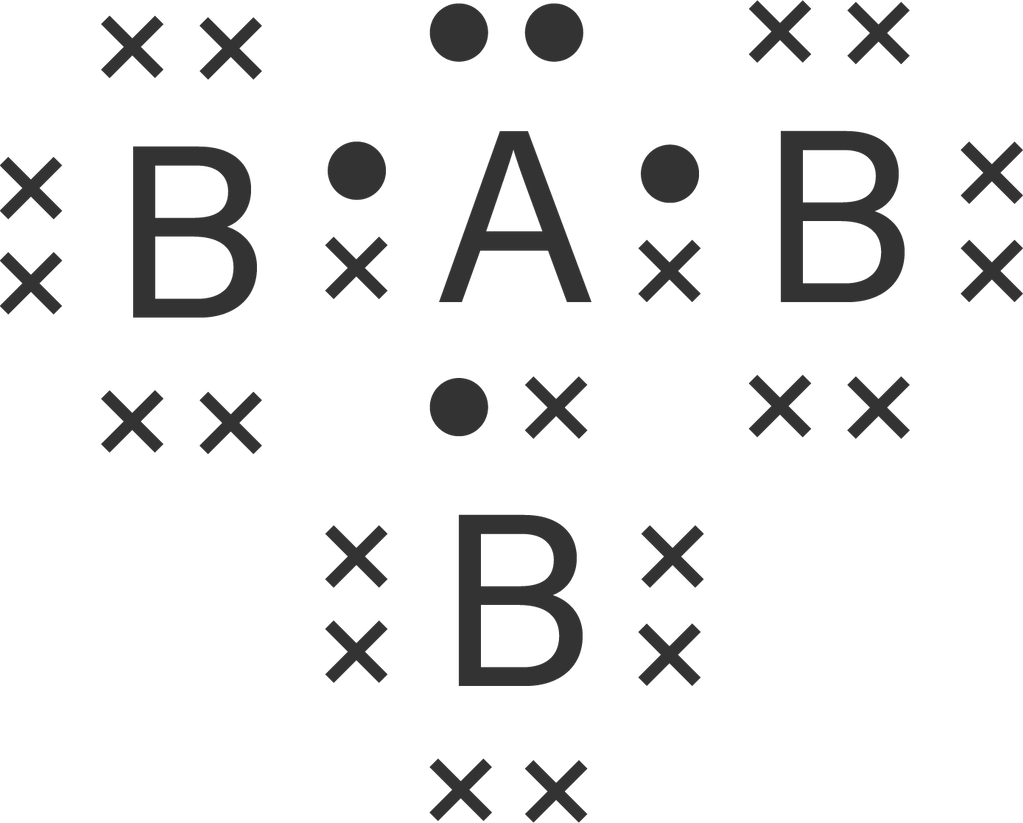Iklan
Pertanyaan
Unsur A yang bernomor atom 15 bersenyawa dengan atom unsur B yang bernomor atom 9. Jika pada atom pusat masih terdapat sepasang elektron bebas, bentuk molekul senyawa yang terbentuk adalah ....
Unsur A yang bernomor atom 15 bersenyawa dengan atom unsur B yang bernomor atom 9. Jika pada atom pusat masih terdapat sepasang elektron bebas, bentuk molekul senyawa yang terbentuk adalah ....
segitiga sama sisi
segi empat datar
piramida trigonal
tetrahedral
trigonal bipiramida
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
8
5.0 (1 rating)
DR
Dhafin Rizkiya
Pembahasan lengkap banget Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia