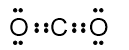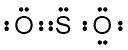Untuk meramalkan bentuk molekul dengan model VSEPR, terlebih dahulu harus menentukan jumlah domain
di sekitar atom pusat melalui penggambaran struktur Lewis.

Elektron valensi C: 4
Elektron valensi O: 6
Total elektron valensi = 4 + 2(6) = 16
Strutur Lewis:
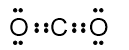
Bentuk molekul berdasarkan teori VSEPR, bentuk molekul dapat diketahui dari Pasangan Elektron Ikatan (PEB) dan Pasangan Elektron Bebas (PEB) dengan rumus berikut:

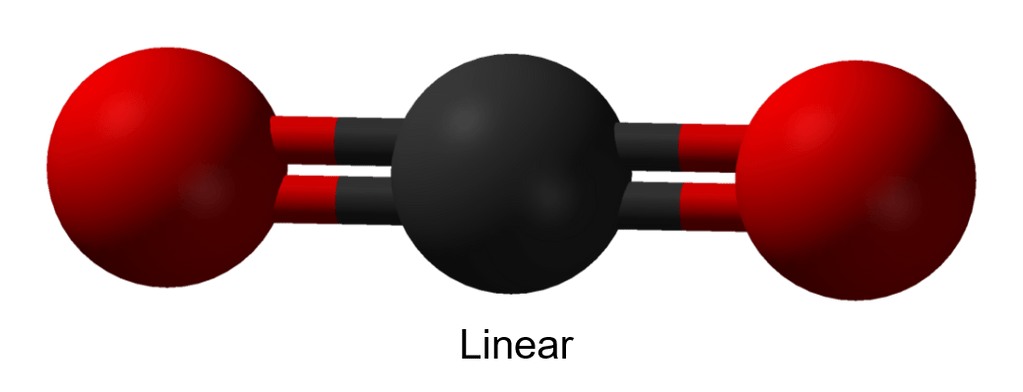
dimana m menunjukkan banyaknya PEI dan n menunjukkan banyaknya PEB. Berdasarkan struktur diatas, terlihat bahwa jumlah PEI ada 2 pasang (ikatan rangkap 2 dihitung 1) dan tidak ada PEB. Sehingga rumus umum  adalah
adalah  yang menunjukkan bentuk linier.
yang menunjukkan bentuk linier.

Elektron valensi S: 6
Elektron valensi O: 6
Total elektron valensi = 6 + 2(6) = 18
Strutur Lewis:
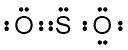
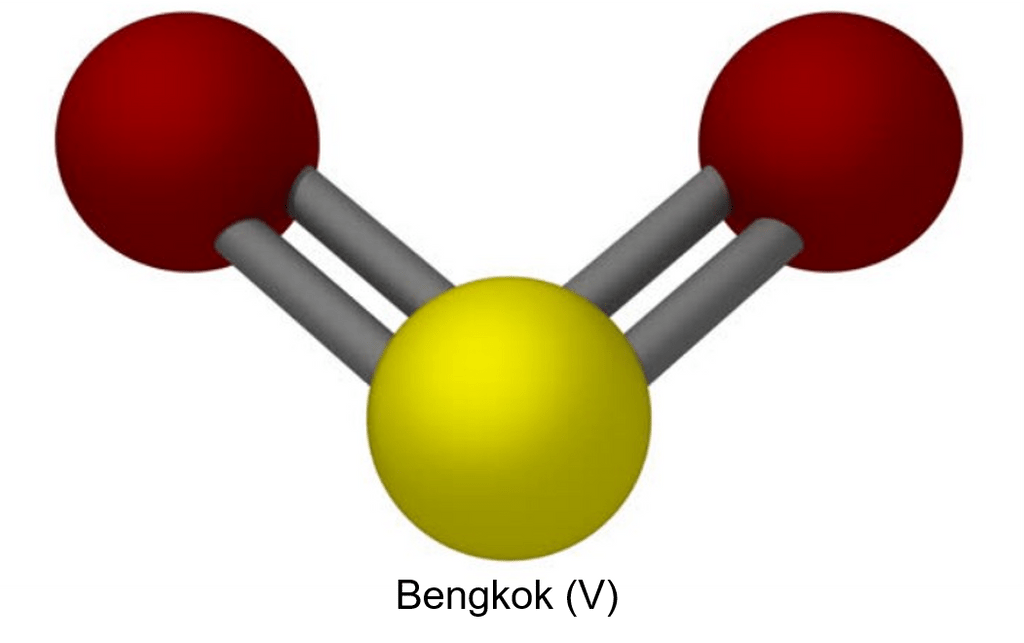
Berdasarkan struktur diatas, terlihat bahwa jumlah PEI ada 2 pasang (ikatan rangkap 2 dihitung 1) dan ada sepasang PEB. Sehingga rumus umum  adalah
adalah  yang menunjukkan bentuk molekul bengkok (V).
yang menunjukkan bentuk molekul bengkok (V).

Elektron valensi I: 7
Elektron valensi F: 7
Total elektron valensi = 7 + 5(7) = 42
Strutur Lewis:

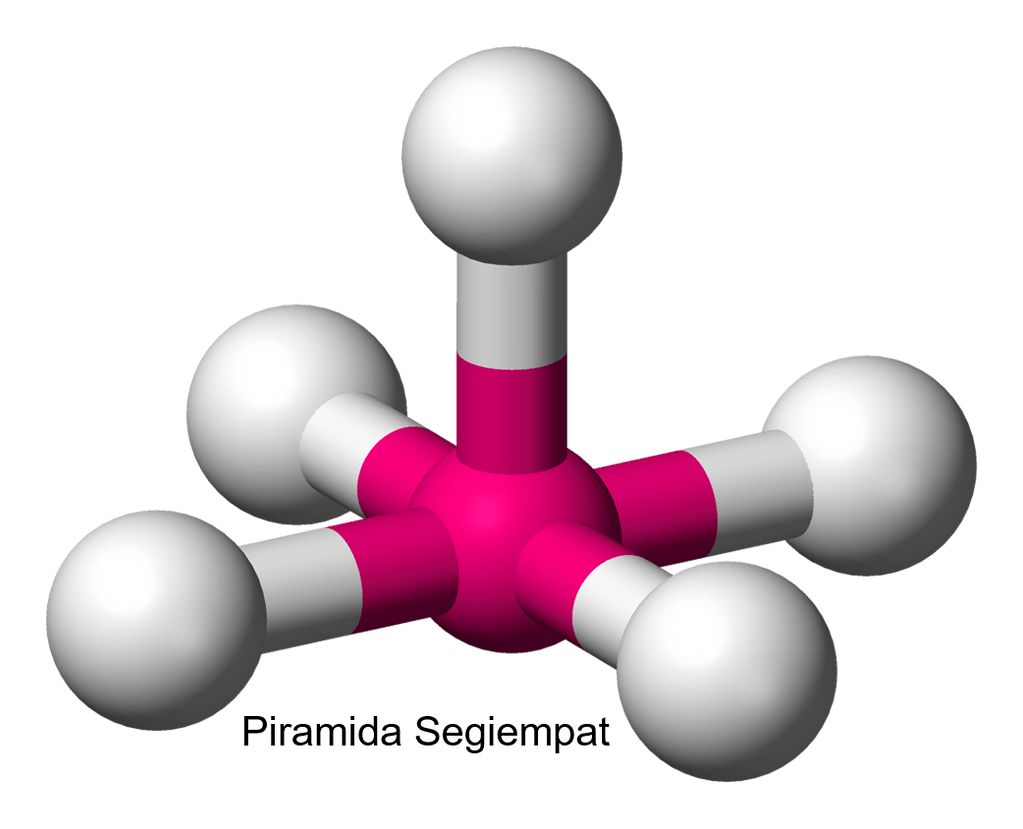
Struktur ini termasuk struktur yang menyimpang aturan Oktet karena elektron valensi atom pusat setelah berikatan lebih dari 8. Berdasarkan struktur diatas, terlihat bahwa jumlah PEI ada 5 pasang dan ada sepasang PEB. Sehingga rumus umum  adalah
adalah  yang menunjukkan bentuk molekul piramida segiempat.
yang menunjukkan bentuk molekul piramida segiempat.
Jadi, bentuk molekul  berturut-turut adalah linier, bengkok, dan piramida segiempat.
berturut-turut adalah linier, bengkok, dan piramida segiempat.