Iklan
Pertanyaan
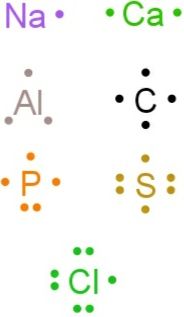
Tuliskan lambang Lewis dari unsur-unsur Na , Ca , Al , C , P , S , Cl ,dan Ar .Bagaimana cara yang paling mungkin terjadi pada masing masing unsur tersebut untuk mencapai aturan oktet, melepas atau menyerap elektron? Jelaskan jawaban Anda!
Tuliskan lambang Lewis dari unsur-unsur , dan . Bagaimana cara yang paling mungkin terjadi pada masing masing unsur tersebut untuk mencapai aturan oktet, melepas atau menyerap elektron? Jelaskan jawaban Anda!
Iklan
AA
A. Acfreelance
Master Teacher
Mahasiswa/Alumni Universitas Sebelas Maret
Jawaban terverifikasi
57
5.0 (4 rating)
c
chaaa
Bantu banget
NM
Nurul MuhLisa
sangat membantu dan Pembahasan lengkap banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia