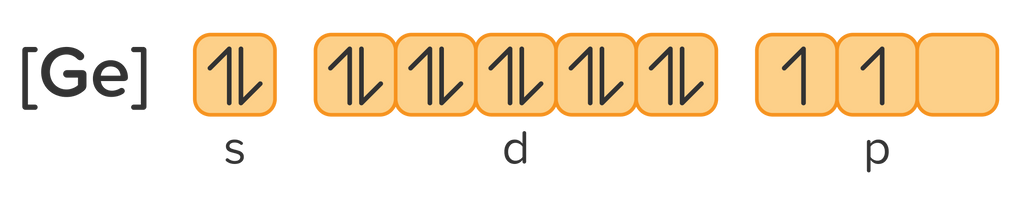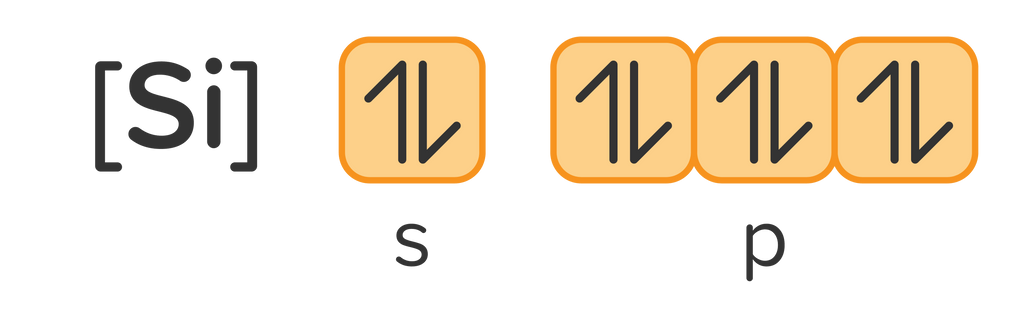Pada mekanika gelombang atau mekanika kuantum, elektron-elektron dalam suatu atom akan tersebar ke dalam orbital-orbital (s, p, d, f, dan seterusnya). Untuk menulis konfigurasi elektron, maka harus mengikuti asas aufbau. Menurut asas AufBau, pada kondisi normal atau pada tingkat dasar, elektron akan menempati orbital yang memiliki energi terendah terlebih dahulu dan diteruskan ke orbital yang memiliki energi lebih tinggi. Untuk penulisan konfigurasi elektron yang mempunyai jumlah elektron besar dapat dilakukan penyederhanaan. Penyederhanaan dilakukan dengan menuliskan simbol dari unsur gas mulia yang mempunyai nomor atom di bawahnya, diikuti dengan penulisan kekurangan jumlah elektron setelah gas mulia tersebut.
Diagram orbital perlu gambarkan mengikuti asas Hund. Frederick Hund, 1927 (dikenal Hund) mengatakan bahwa pengisian elektron pada orbital yang setingkat (energinya sama) dalam satu orbital adalah satu per satu dengan arah spin yang sama sebelum berpasangan. Asas ini dikemukakan berdasarkan penalaran bahwa energi tolak-menolak antara dua elektron akan minimum jika jarak antara elektron berjauhan.
Konfigurasi elektron dan diagram orbital dari masing-masing unsur:
d. 
Konfigurasi elektron: 
Gambar diagram orbital:
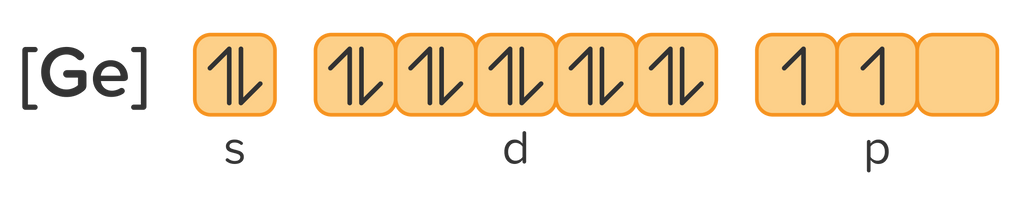
e. 
Konfigurasi elektron: 
Gambar diagram orbital:
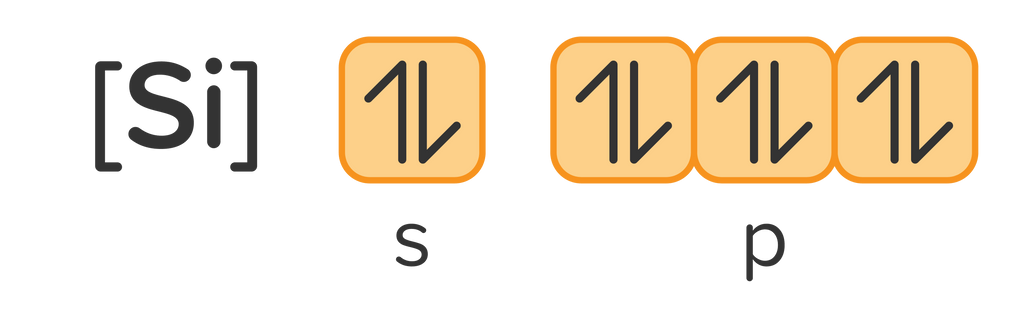
f. 
Konfigurasi elektron: 
Gambar diagram orbital:

Jadi, konfigurasi elektron dan diagram orbital dari masing-masing unsur seperti dijabakan di atas.