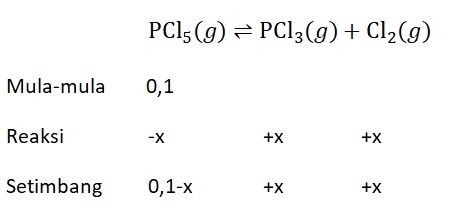Iklan
Pertanyaan
Tetapan kesetimbangan untuk reaksi: PCl 5 ( g ) ⇌ PCl 3 ( g ) + Cl 2 ( g ) pada suhu 760 K adalah 0,05. Jika konsentrasi awal PCl 5 0,1 mol/L, tentukanlah yang terurai pada keadaan setimbang !
Tetapan kesetimbangan untuk reaksi:
pada suhu 760 K adalah 0,05. Jika konsentrasi awal 0,1 mol/L, tentukanlah yang terurai pada keadaan setimbang !
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
17
4.8 (25 rating)
AD
Aisyah Dwi Lesmana
Penjelasannya detail banget. Terima kasih banyak! Ini sangat membantu!
na
naya amelia
Pembahasan lengkap banget
A
Anon
Pembahasan lengkap banget
FC
Febrioni Cahya Sabrina
Makasih ❤️ Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget
S
Shifu
Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia