Persamaan reaksi dikatakan sebagai suatu redoks apabila dalam reaksi tersebut terdapat reaksi reduksi dan oksidasi, bukan salah satu. Untuk menetukan redoks atau bukan dapat kita ketahui dari perubahan bilangan oksidasi.
Berikut beberapa aturan biloks yang digunakan dalam menyelesaikan soal ini:
- Jumlah biloks ion poliatomik sesuai dengan muatannya
- Biloks oksigen pada umumnya adalah -2, kecuali pada senyawa peroksida (-1) dan superoksida (
 )
)
- Biloks pada unsur bebas adalah 0
- Jumlah biloks pada senyawa netral adalah 0
- Biloks unsur gol I, II, dan III sesuai dengan golongannya (+1, +2, dan +3).
Menghitung biloks
- Biloks S pada


dengan menggunakan aturan biloks nomor 1 (Jumlah biloks ion poliatomik sesuai dengan muatannya)

dengan menggunakan aturan biloks nomor 2 (Biloks oksigen pada umumnya adalah -2, kecuali pada senyawa peroksida (-1) dan superoksida ( ))
))

- Biloks S pada


dengan menggunakan aturan biloks nomor 1 (Jumlah biloks ion poliatomik sesuai dengan muatannya)

dengan menggunakan aturan biloks nomor 2 (Biloks oksigen pada umumnya adalah -2, kecuali pada senyawa peroksida (-1) dan superoksida ( ))
))

- Menghitung biloks I pada

dengan menggunakan aturan biloks nomor 3 (Biloks pada unsur bebas adalah 0), sehingga biloks I pada senyawa  adalah 0
adalah 0
- Menghitung biloks I pada

dengan menggunakan aturan biloks nomor 4 (Jumlah biloks pada senyawa netral adalah 0)

dengan menggunakan aturan biloks nomor 5 (Biloks unsur gol I, II, dan III sesuai dengan golongannya (+1, +2, dan +3))

terjadi perubahan bilangan oksidasi seperti pada reaksi dibawah ini:
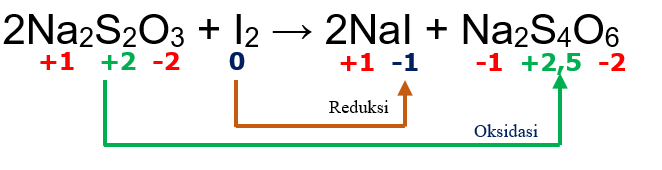
Dari reaksi diatas dapat disimpulkan bahwa  mengalami oksidasi menjadi
mengalami oksidasi menjadi  , sedangkan
, sedangkan  mengalami reduksi menjadi
mengalami reduksi menjadi  .
.
Jadi, reaksi diatas termasuk redoks.


















