Iklan
Pertanyaan
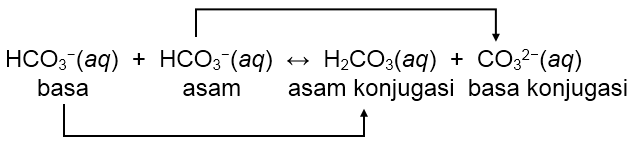
Tentukan pasangan asam-basa konjugasi dalam reaksi-reaksi berikut! HCO 3 − ( a q ) + HCO 3 − ( a q ) ⇌ H 2 CO 3 ( a q ) + CO 3 2 − ( a q )
Tentukan pasangan asam-basa konjugasi dalam reaksi-reaksi berikut!

8 dari 10 siswa nilainya naik
dengan paket belajar pilihan
Habis dalam
00
:
18
:
43
:
01
Iklan
AC
A. Chandra
Master Teacher
Mahasiswa/Alumni Universitas Negeri Jakarta
Jawaban terverifikasi
1
5.0 (1 rating)
RH
Raihana Hafidza
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia