Kepolaran merupakan terbentuknya kutub positif dan negatif akibat adanya pasangan elektron yang lebih tertarik ke salah satu atom disebabkan perbedaan keelektronegatifan. Dengan demikian, molekul yang disusun dari unsur-unsur sama akan memiliki perbedaan keelektronegatifan = 0. Sehingga molekul N2 termasuk senyawa kovalen nonpolar.
Sedangkan molekul HF disusun oleh dua unsur yang memiliki nilai keelektronegatifan berbeda. Unsur H adalah unsur yang sangat elektropositif sedangkan F adalah unsur yang paling elektronegatif. Dengan demikian beda keelektronegatifannya akan besar. Maka molekul HF termasuk senyawa kovalen polar.
Namun demikian, kepolaran dalam suatu molekul tidak terjadi hanya karena perbedaan keelektronegatifan atom-atom yang berikatan saja, melainkan juga karena distribusi elektron dalam molekulnya. Unsur P memiliki 5 elektron valensi, sehingga ketika ada 3 atom Cl berikatan dalam PCl3, terdapat 2 elektron atau sepasang elektron bebas (PEB) pada atom pusat. Gaya tolak PEB jauh lebih kuat dibandingkan gaya tolak pasangan elektron ikatan berdasarkan teori VSEPR, sehingga bentuk molekulnya adalah segitiga piramida.
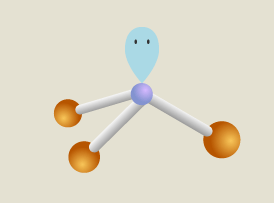
Daerah PEB akan membentuk kutub negatif dan pada sisi berlawanan akan terbentuk kutub positif. Jika ikatan Cl dengan P digambarkan sebagai vektor, tidak berada pada arah yang berlawanan sehingga resultan vektor atau momen dipolnya tidak sama dengan 0. Dengan demikian, molekul ini bersifat polar.
Jadi, gas nitrogen termasuk nonpolar, sedangkan HF dan PCl3 merupakan molekul polar.
















