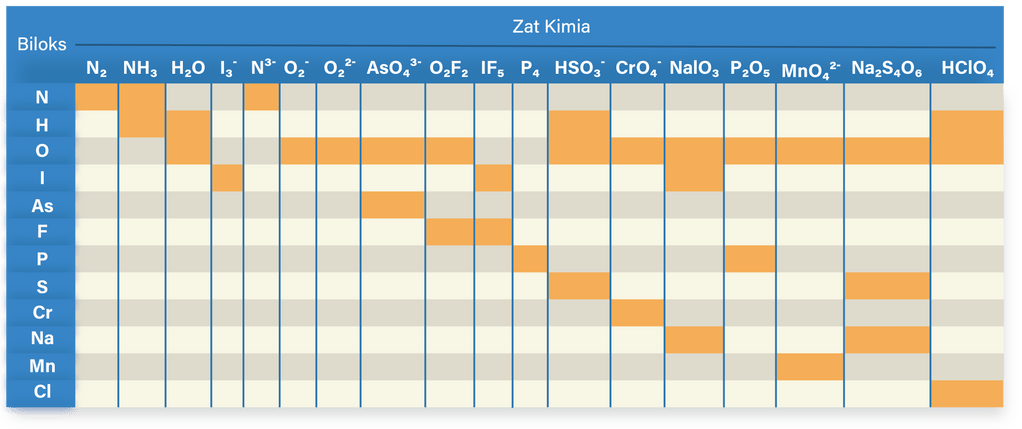
Nilai bilangan oksidasi masing-masing unsur sesuai dengan tabel di bawah ini.
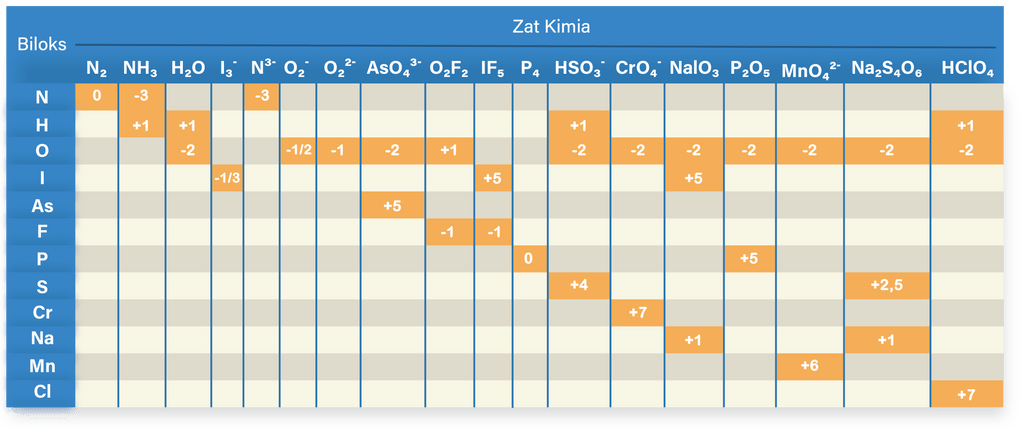
Berikut adalah cara menentukan bilangan oksidasi (biloks) unsur pada ion atau senyawanya:
Bilangan oksidasi N pada N2, NH3, dan N3−
- Biloks N pada N2 adalah 0, karena N2 merupakan unsur bebas.
- Biloks N pada NH3 adalah -3 karena biloks H adalah +1. NH3 merupakan senyawa netral maka jumlah bilangan oksidasi harus sama dengan 0.
- Biloks N pada N3− adalah -3, karena biloks ion monoatomik sama dengan muatannya.
Bilangan oksidasi H pada NH3, H2O,  , dan HClO4
, dan HClO4
- Biloks H pada senyawa umumnya adalah +1, kecuali pada senyawa hidrida, biloks H adala -1. Karena keempat senyawa di atas tidak ada yang merupakan senyawa hidrida maka biloks H pada keempat senyawa di atas adalah +1.
Bilangan oksidasi O pada H2O,  , O22−, AsO43−, O2F2,
, O22−, AsO43−, O2F2,  ,
,  , NaOI3, P2O5, MnO42−, Na2S4O6, dan HClO4
, NaOI3, P2O5, MnO42−, Na2S4O6, dan HClO4
- Biloks O pada senyawa umumnya adalah -2, kecuali pada senyawa O2F2, peroksida, dan superoksida. Jadi biloks O pada senyawa serta ion H2O, AsO43−, HSO3−, CrO4−, NaOI3, P2O5, MnO42−, Na2S4O6, dan HClO4 adalah -2.
- Biloks O pada ion O2− adalah −21. Senyawa dimana biloks O sama dengan -1/2 disebut dengan senyawa superoksida.
- Biloks O pada ion O22− adalah -1. Senyawa dimana biloks O sama dengan -1 disebut dengan senyawa peroksida.
- Biloks O pada senyawa O2F2 adalah +1. Hal ini dikarenakan biloks F pada senyawa adalah -1 sehingga biloks O menjadi +1.
Bilangan oksidasi I pada  , IF5, dan NaIO3
, IF5, dan NaIO3
- Biloks I pada I3− adalah −31, karena jumlah biloks ion monoatomik sama dengan muatannya.
- Biloks I pada IF5 adalah +5, karena biloks F pasti -1 dan jumlah biloks senyawa netral sama dengan 0.
- Biloks I pada NaIO3 adalah +5, karena biloks Na pasti +1, biloks O pada senyawa adalah -2, dan jumlah biloks senyawa netral harus sama dengan 0.
Bilangan oksidasi As pada AsO43−
- Biloks As pada AsO43− adalah +5, karena biloks O umumnya adalah -2, dan jumlah biloks pada ion harus sama dengan muatannya.
Bilangan oksidasi F pada O2F2 dan IF5
- Biloks F pada senyawa pasti sama dengan -1. Jadi biloks F pada senyawa O2F2 dan IF5 adalah -1.
Bilangan oksidasi P pada P4 dan P2O5
- Biloks P pada P4 adalah 0, karena P4 merupakan unsur bebas.
- Biloks P pada P2O5 adalah +5, karena biloks O pada senyawa umumnya adalah -2 dan jumlah biloks pada senyawa netral sama dengan 0.
Bilangan oksidasi S pada  dan Na2S4O6
dan Na2S4O6
- Biloks S pada HSO3− adalah +4, karena biloks H pada senyawa umumnya adalah +1, biloks O pada senyawa umumnya adalah -2, dan jumlah biloks pada ion poliatomik sama dengan muatannya.
- Biloks S pada Na2S4O6 adalah +2,5. Hal ini dikarenakan biloks Na adalah +1, biloks O pada senyawa umumnya dalah -2, dan jumlah biloks pada senyawa netral sama dengan 0.
Bilangan oksidasi Cr pada 
- Biloks Cr pada CrO4− adalah +7, karena biloks O pada senyawa umumnya adalah -2 dan jumlah biloks pada ion poliatomik sama dengan muatannya.
Bilangan oksidasi Na pada NaOI3 dan Na2S4O6
- Biloks Na pada senyawa pasti sama dengan +1. Jadi biloks Na pada NaOI3 dan Na2S4O6 adalah +1.
Bilangan oksidasi Mn pada MnO42−
- Biloks Mn pada MnO42− adalah +6, karena biloks O pada senyawa umumnya adalah -2 dan jumlah biloks pada ion poliatomik sama dengan muatannya.
Bilangan oksidasi Cl pada HClO4
- Biloks Cl pada HClO4 adalah +7, karena biloks H pada senyawa umumnya adalah +1, biloks O pada senyawa umumnya adalah -2 dan jumlah biloks senyawa netral sama dengan 0.