Bilangan kuantum adalah bilangan yang menyatakan letak kedudukan elektron-elektron dalam suatu atom. Pada dasarnya, bilangan kuantum dibagi menjadi 4, yaitu :
1. Bilangan kuantum utama(n) menyatakan kulit tempat elektron berada.
kulit pertama (n=1), disebut kulit K.
kulit kedua (n=2), disebut kulit L
kulit ketiga (n=3), disebut kulit M
dst.
2. Bilangan kuantum azzimuth (l) menyatakan subkulit tempat elektron berada.
subkulit s, bilangan kuantum azzimuth (l)=0
subkulit p, bilangan kuantum azzimuth (l)=1
subkulit d, bilangan kuantum azzimuth (l)=2
subkulit f, bilangan kuantum azzimuth (l)=3
3. Bilangan kuantum magnetik (m) menyatakan orbital khusus tempat elektron berada serta orientasi orbital dalam ruangan relatif terhadap inti.
subkulit s, bilangan kuantum azzimuth (l)=0, bilangan kuantum magnetik (m)=0 (1 orbital)
subkulit p, bilangan kuantum azzimuth (l)=1, bilangan kuantum magnetik (m)=-1,0,+1 (3 orbital)
subkulit d, bilangan kuantum azzimuth (l)=2, bilangan kuantum magnetik (m)=-2,-1,0,+1,+2 (5 orbital)
subkulit f, bilangan kuantum azzmituh (l)=3, bilangan kuantum magnetik (m)=-3,-2,-1,0,+1,+2,+3 (7 orbital)
4. Bilangan kuantum spin (s) menunjukkan arah rotasi elektron dalam orbitalnya dan dinyatakan dengan panah. Panah keatas (s=+1/2), panah kebawah (s=-1/2).
Konfigurasi elektron 
Elektron terakhir pada subkulit  dengan orbital :
dengan orbital :
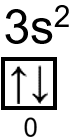
- Bilangan kuantum utama (n) = 3
- Bilangan kuantum azimuth (l) = 0
- Bilangan kuantum magnetik (m) = 0
- Bilangan kuantum spin (s) =

Jadi, elektron terakhir pada atom Mg memiliki nilai keempat bilangan kuantum yaitu n=3, l=0, m=0 dan s= .
.


















