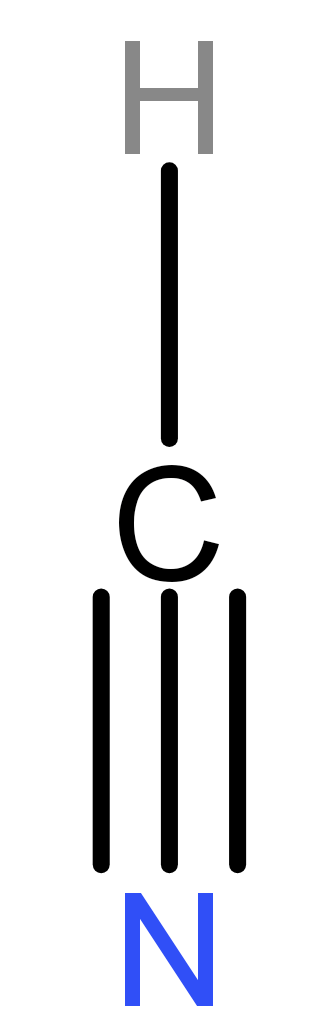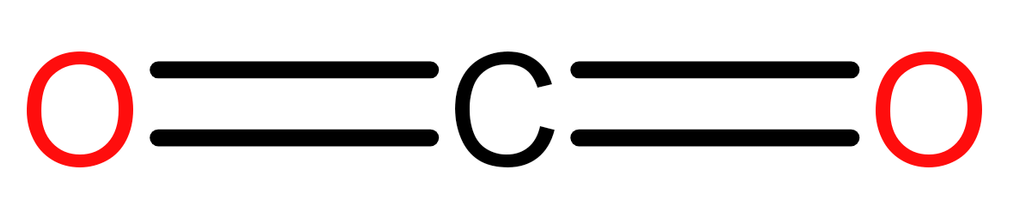Aturan oktet menyatakan bahwa suatu atom dapat stabil apabila memiliki konfigurasi elektron penuh (8 elektron) seperti gas mulia. Namun kenyataannya di alam, beberapa senyawa bersifat stabil meskipun tidak mencapai oktet atau kelebihan oktet.
Untuk mengetahui mana yang menyimpang dari aturan oktet, gambarkan rumus struktur masing-masing senyawa. Jika di sekitar atom pusat tidak mencapai atau lebih dari 8 elektron, berarti senyawa tersebut menyimpang dari aturan oktet. Perhatikan bahwa 1 garis ikatan menyatakan 2 elektron.
Opsi A:
Unsur B memiliki 3 elektron valensi dan unsur I memiliki 7 elektron valensi.
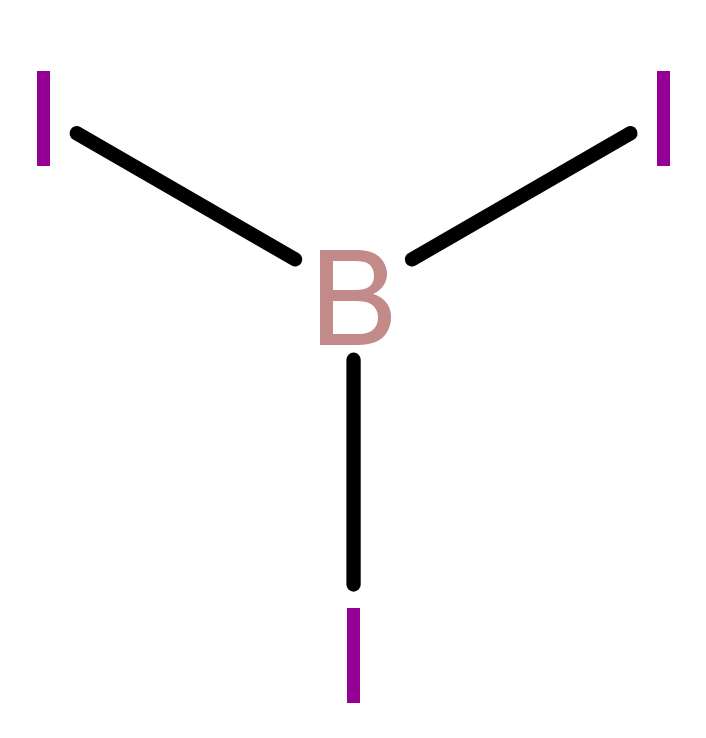
Di sekitar unsur B hanya ada 6 elektron, berarti senyawa ini menyimpang dari aturan oktet.
Opsi B:
Unsur H memiliki 1 elektron valensi, unsur C memiliki 4 elektron valensi, dan unsur N memiliki 5 elektron valensi.
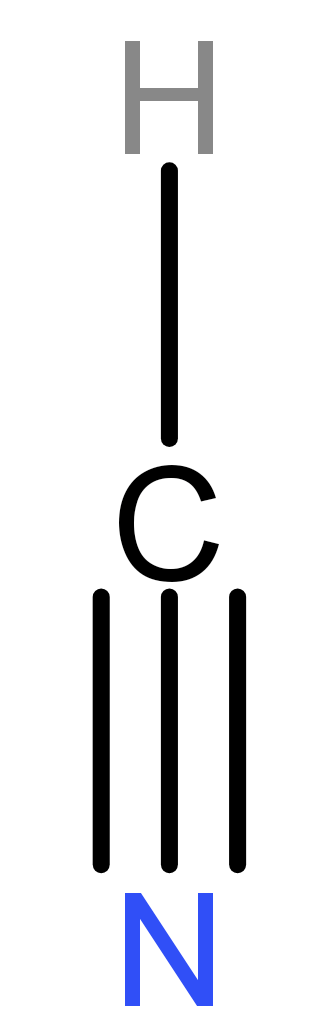
Di sekitar unsur C ada 8 elektron, berarti senyawa ini memenuhi aturan oktet.
Opsi C:
Unsur P memiliki 5 elektron valensi dan unsur Cl memiliki 7 elektron valensi.
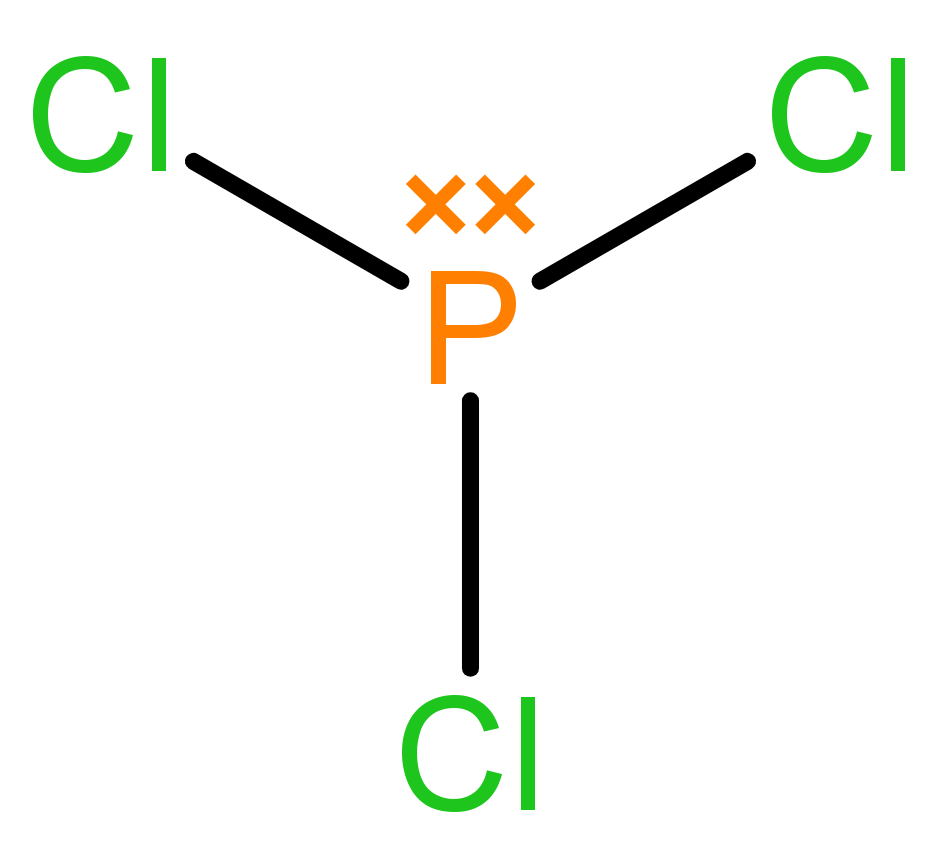
Di sekitar unsur P ada 8 elektron, berarti senyawa ini memenuhi aturan oktet.
Opsi D:
Unsur C memiliki 4 elektron valensi dan unsur Cl memiliki 7 elektron valensi.
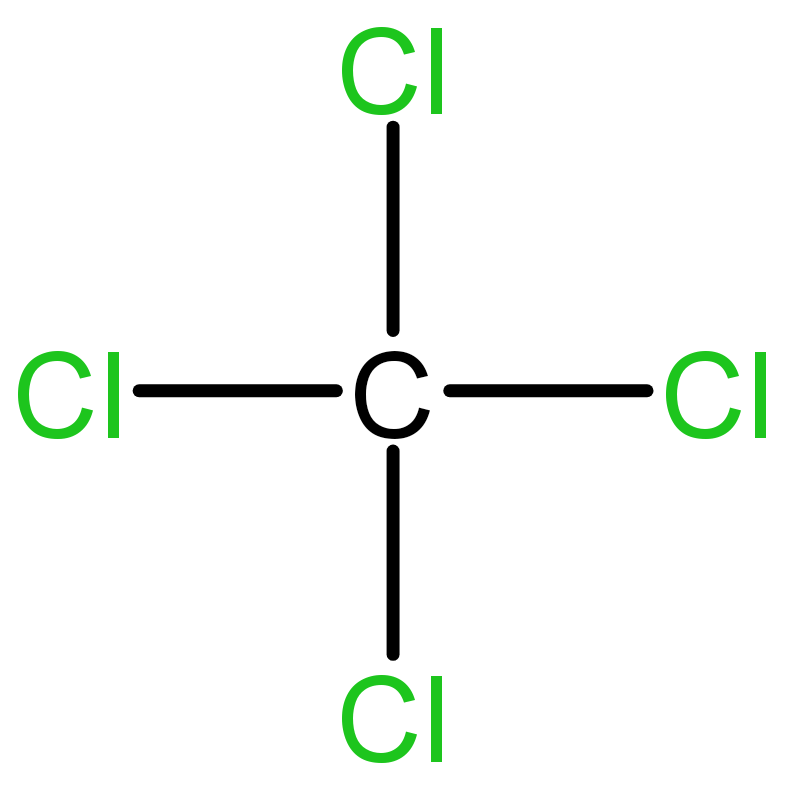
Di sekitar unsur C ada 8 elektron, berarti senyawa ini memenuhi aturan oktet.
Opsi E:
Unsur C memiliki 4 elektron valensi dan unsur O memiliki 6 elektron valensi.
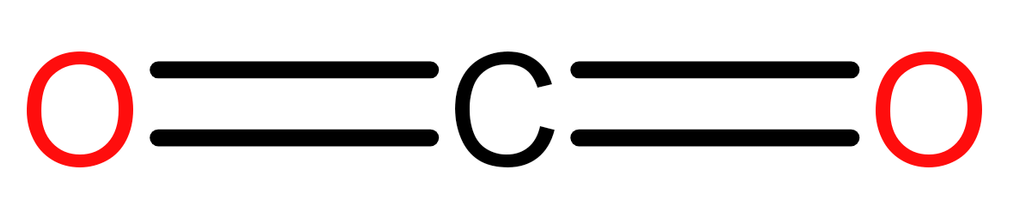
Di sekitar unsur C ada 8 elektron, berarti senyawa ini memenuhi aturan oktet.
Jadi, jawaban yang tepat adalah A.