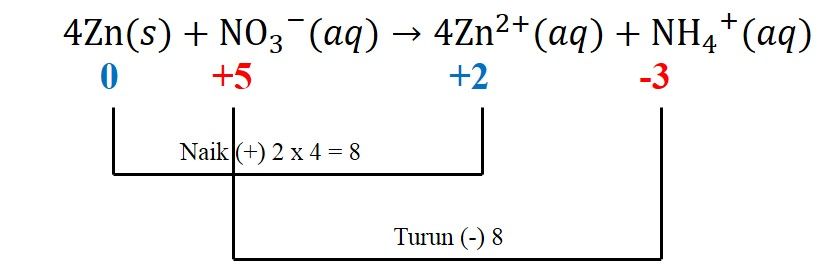Penyetaraan reaksi redoks dapat dilakukan dalam suasana asam dan basa dengan berbagai cara, di antaranya metode setengah reaksi dan metode bilangan oksidasi.
Berikut langkah-langkah penyetaraan reaksi redoks dengan metode setengah reaksi dalam suasana asam:
1) Menyetarakan jumlah setiap atom yang terlibat pada reaksi tersebut dengan menambahkan koefisien (pada kasus ini sudah setara)


2) Menyetarakan jumlah atom O dengan menambahkan senyawa  pada daerah yang kekurangan oksigen
pada daerah yang kekurangan oksigen


3) Menyetarakan jumlah atom H dengan menambahkan ion  di ruas yang berlawanan (daerah yang kekurangan hidrogen)
di ruas yang berlawanan (daerah yang kekurangan hidrogen)


4) Menyetarakan jumlah muatan dengan menambahkan elektron  pada ruas yang total muatannya lebih positif
pada ruas yang total muatannya lebih positif


5) Menyetarakan jumlah  yang dilepas dengan yang diterima
yang dilepas dengan yang diterima
 x 4
x 4
 x 1
x 1
sehingga diperoleh:


6) Menjumlahkan kedua reaksi

7) Mengeliminasi spesi yang sama pada kedua ruas (pada kasus ini hanya  yang sama)
yang sama)
 (reaksi setara)
(reaksi setara)
Adapun langkah-langkah penyetaraan reaksi redoks dengan metode bilangan oksidasi (biloks) dalam suasana asam sebagai berikut:
1) Menyetarakan jumlah setiap atom yang terlibat pada reaksi tersebut dengan menambahkan koefisien (pada kasus ini jumlah atom sudah setara)

2) Menentukan biloks atom yang mengalami kenaikan dan penurunan biloks
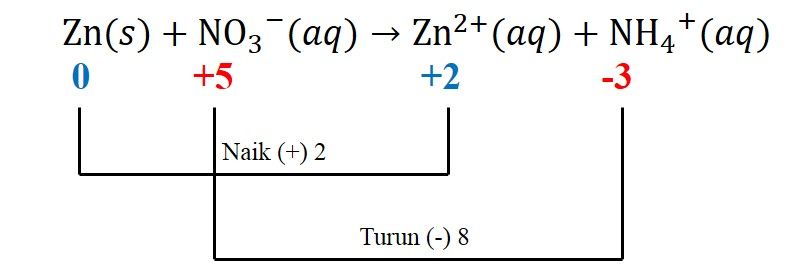
3) Menyetarakan perubahan biloks yang naik dan turun (pada kasus ini, spesi biloks berwarna biru dikalikan 4)
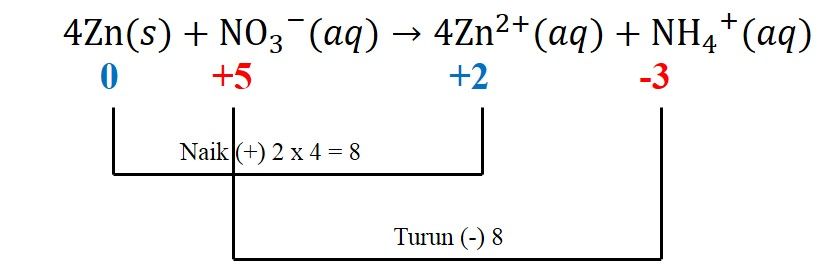
4) Menyetarakan jumlah muatan ruas pereaksi produk dengan menambahkan ion  (pada kasus ini, jumlah muatan pereaksi -1 dan produk +9, dibutuhkan 10
(pada kasus ini, jumlah muatan pereaksi -1 dan produk +9, dibutuhkan 10 pada pereaksi)
pada pereaksi)

5) Menyetarakan jumlah atom  dengan menambahkan senyawa
dengan menambahkan senyawa 
 (reaksi setara)
(reaksi setara)
Jadi, reaksi setaranya adalah

(suasana asam)