Iklan
Pertanyaan
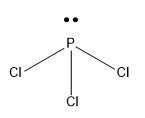
Senyawa yang terletak pada golongan VA yang memiliki konfigurasi unsur dua subkulit terakhirnya adalah 3 s 2 3 p 3 bersenyawa dengan unsur golongan VIIA yang memiliki konfigurasi unsur dua subkulit 3 s 2 3 p 5 , tentukanlah: a) Senyawa yang terbentuk b) Banyaknya pasangan elektron bebas c) Bentuk molekulnya d) Gaya yang bekerja pada molekul tersebut
Senyawa yang terletak pada golongan VA yang memiliki konfigurasi unsur dua subkulit terakhirnya adalah bersenyawa dengan unsur golongan VIIA yang memiliki konfigurasi unsur dua subkulit , tentukanlah:
a) Senyawa yang terbentuk
b) Banyaknya pasangan elektron bebas
c) Bentuk molekulnya
d) Gaya yang bekerja pada molekul tersebut
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
3
0.0 (0 rating)
Iklan
Iklan
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia