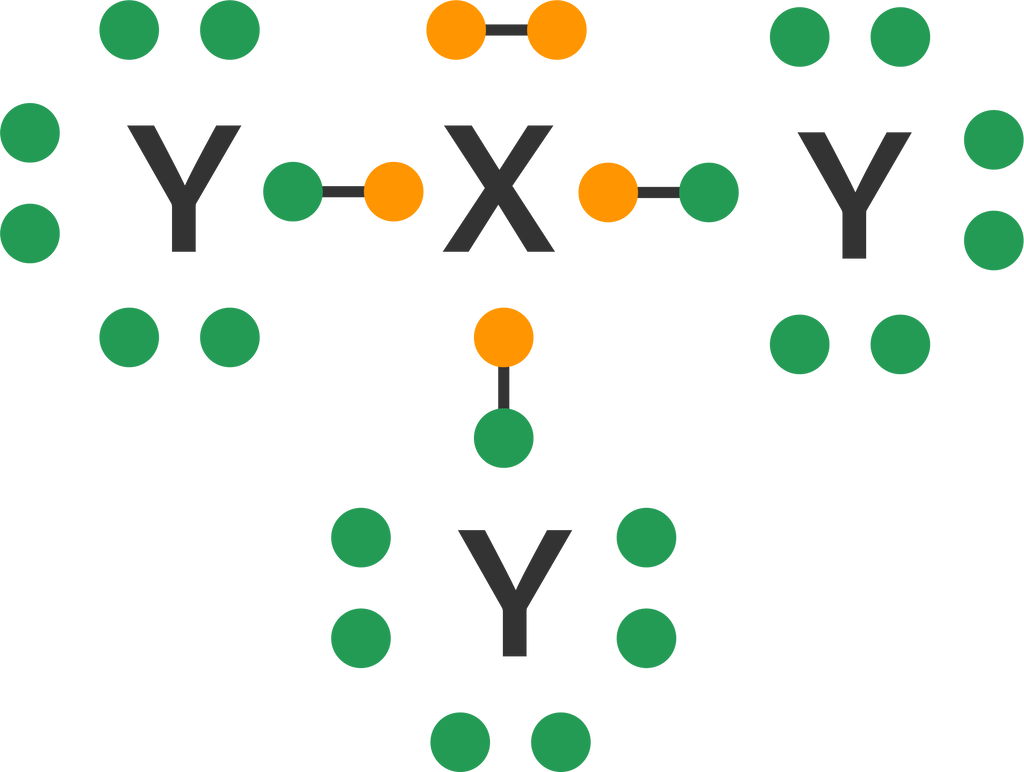Struktur ruang suatu molekul dapat diramalkan berdasarkan adanya Pasangan Elektron lkatan (PEl) dan Pasangan Elektron Bebas (PEB) pada kulit terluar dari atom pusat di dalam molekul tersebut. Pasangan elektron yang terdapat pada kulit terluar dari suatu atom pusat memiliki muatan sejenis sehingga terjadi suatu gaya tolak-menolak. Pasangan-pasangan elektron ini akan memperkecil gaya tolak-menolak tersebut dengan membentuk suatu susunan tertentu. Teori ini dikenal sebagai Teori Tolakan Pasangan Elektron Kulit Valensi atau Teori VSEPR (Valence Shell Electron Pair Repulsion).
Senyawa-senyawa yang memiliki PEB dirumuskan dengan notasi A, X, E, dengan A sebagai atom pusat, X sebagai elektron yang berikatan, dan E merupakan pasangan elektron bebas. Untuk dapat mengetahui notasi A, X, dan E pada senyawa, maka perlu dibuat struktur Lewisnya terlebih dahulu. Atom dengan nomor atom 15 memiliki 5 elektron valensi dan atom dengan nomor atom 17 memiliki 7 elektron valensi. Misalkan unsur dengan nomor atom 15 adalah unsur X dan dengan nomor atom 17 adalah unsur Y, maka senyawa yang terbentuk dari kedua unsur tersebut jika dibuar struktur Lewisnya adalah sebagai berikut.
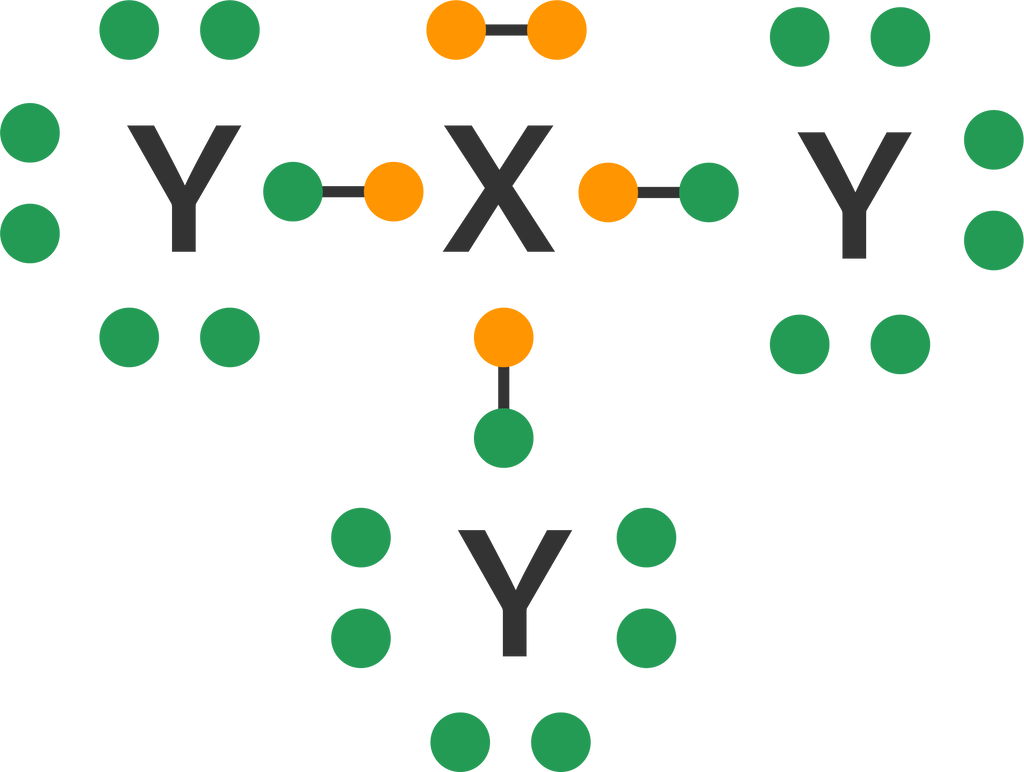
Berdasarkan struktur Lewis senyawa XY3 di atas, dapat diketahui bahwa atom X yang memiliki 5 elektron valensi, mengikat 3 buah atom Y yang bervalensi 7. Tiga buah elektron atom X mengikat masing-masing 1 elektron dari atom Y, sedangkan 2 elektron lainnya menjadi pasangan elektron bebas. Dengan demikian, dalam senyawa tersebut terdapat 3 pasangan elektron ikatan (PEI) dan 1 buah pasangan elektron bebas (PEB). Notasi A, X, E senyawa tersebut yaitu AX3E. Semua atom pada senyawa XY3 mengikuti kaidah oktet, karena semua atomnya memiliki 8 elektron, termasuk elektron yang digunakan berikatan bersama sebagai ikatan kovalen.
Dengan demikian, maka senyawa yang terbentuk dari atom dengan Z = 15 dan Z = 17 memiliki 3 PEI dan 1 buah PEB.
Jadi, jawaban yang tepat adalah B.