Ikatan kovalen dapat berupa ikatan kovalen polar dan ikatan kovalen nonpolar. Sifat kepolaran ikatan ini dipengaruhi oleh perbedaan keelektronegatifan antar atom-atom penyusunnya dan bentuk molekul dari senyawa tersebut. Perbedaan keelektronegatifan atom-atom dalam suatu molekul yang semakin besar akan menyebabkan ikatan pada molekul tersebut bersifat semakin polar. Bentuk molekul yang simetris pada suatu senyawa menyebabkan molekulnya bersifat nonpolar, sedangkan senyawa dengan bentuk molekul asimetris (tidak simetris) akan cenderung bersifat polar.
Bentuk molekul yang simetris menyebabkan tidak adanya pemisahan muatan sehingga dipol tidak terbentuk. Jadi, walaupun ikatannya bersifat polar, tetapi molekulnya bersifat nonpolar. Senyawa yang pada atom pusat dari molekulnya memiliki pasangan elektron bebas (PEB), bentuk molekulnya menjadi tidak simetris karena adanya gaya tolak-menolak dari pasangan elektronnya. Hal inilah yang menyebabkan senyawa yang bentuk molekulnya asimetris akan bersifat polar.
Contoh senyawa yang memiliki bentuk molekul simetris dan bersifat nonpolar, yaitu CH4, BH3, N2 dan I2. Bentuk molekul dari keempat senyawa tersebut dapat diprediksi dari struktur Lewisnya, yaitu sebagai berikut.
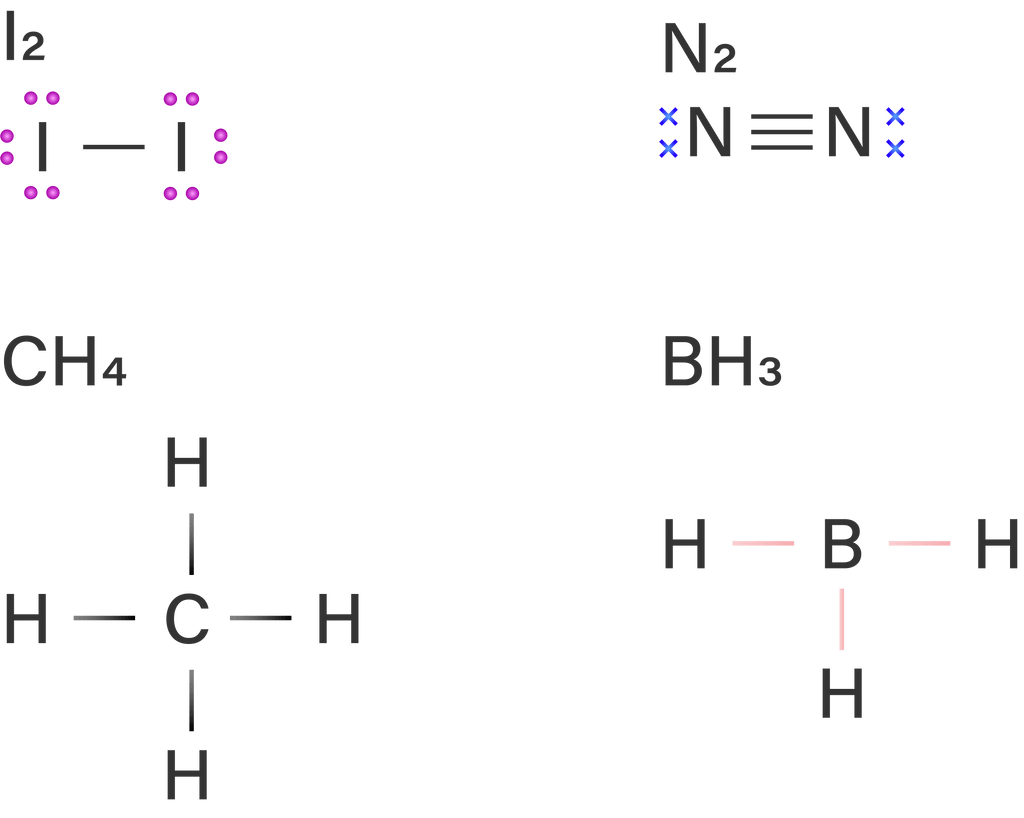
Berdasarkan struktur Lewis di atas, dapat diketahui bahwa pada atom pusat dari senyawa-senyawa tersebut tidak terdapat pasangan elektron bebas (PEB). Elektron yang dimiliki atom pusat dari unsur karbon (C) dan unsur boron (B) pada CH4 dan BH3 semuanya terpakai untuk berikatan, sehingga tidak memiliki PEB. Pada molekul N2 dan I2, tidak terdapat atom pusat karena terdiri dari 2 unsur yang sama sehingga molekul berbentuk linier dan tidak ada perbedaan keelektronegatifan pada unsur-unsur penyusunnya. Hal tersebut yang menyebabkan keempat senyawa tersebut bersifat nonpolar.
Senyawa yang memiliki bentuk molekul asimetris dan bersifat polar diantaranya adalah NH3 dan H2O. Kedua senyawa tersebut memiliki pasangan elektron bebas (PEB) pada atom pusatnya, sehingga bentuk molekulnya asimetris. Struktur Lewis dari senyawa NH3 adalah sebagai berikut.
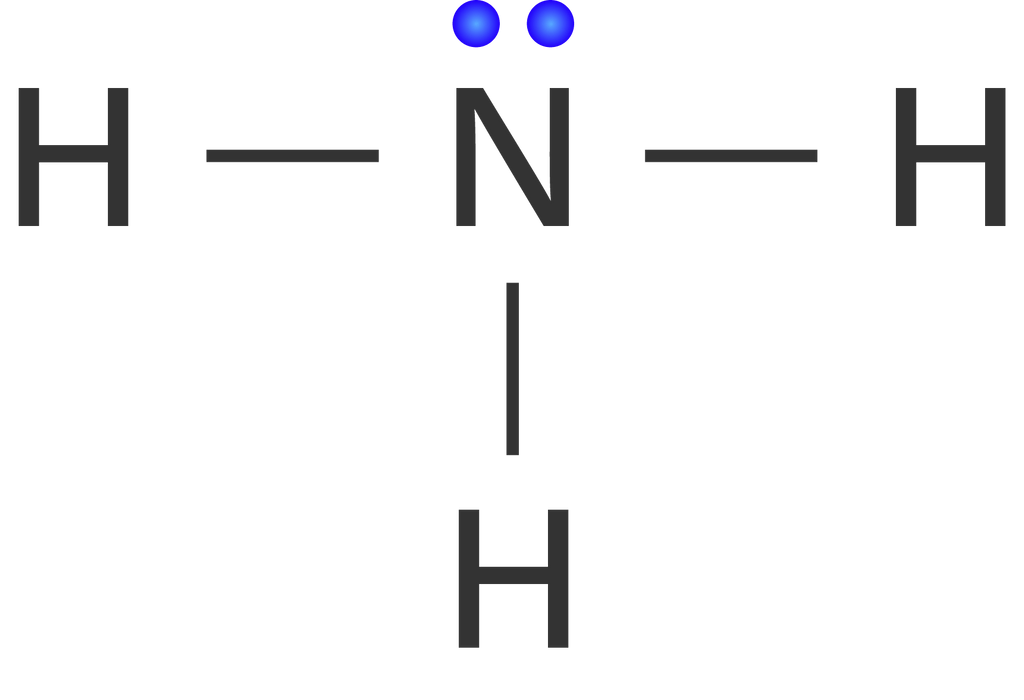
Berdasarkan gambar di atas, dapat diketahui bahwa senyawa NH3 memiliki 1 buah pasangan elektron bebas (PEB) pada atom pusatnya, yaitu unsur N. Adanya PEB pada atom pusat NH3 menyebabkan adanya gaya tolakan dari pasangan elektron bebasnya terhadap elektron yang berikatan, sehingga terdapat perbedaan muatan yang menyebabkan sifatnya polar.
Dengan demikian, maka senyawa yang berikatan kovalen polar adalah NH3.
Jadi, jawaban yang tepat adalah E.

















