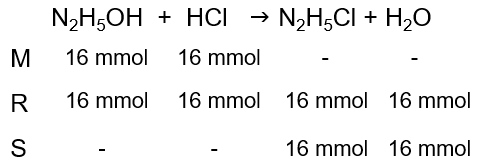Iklan
Pertanyaan
Sebanyak 200 ml N 2 H 4 0,08 M ( K b = 1 × 1 0 − 6 ) direaksikan dengan 200 mL larutan HCl 0,08 M. pH campuran setelah bereaksi adalah ....
Sebanyak 200 ml 0,08 M direaksikan dengan 200 mL larutan 0,08 M. pH campuran setelah bereaksi adalah ....
Iklan
AA
A. Acfreelance
Master Teacher
Jawaban terverifikasi
1
4.5 (7 rating)
NP
Nabila Putri
Pembahasan lengkap banget Mudah dimengerti Ini yang aku cari! Bantu banget Makasih ❤️
sa
sabila ajrina ramadhani
Pembahasan lengkap banget
SE
SAMANTHA EUNIKE MONIAGA / 28
Makasih ❤️
FD
Fadhil Dwi putra
Pembahasan lengkap banget
SH
Salwa Hafshah
Pembahasan tidak lengkap Pembahasan tidak menjawab soal
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia