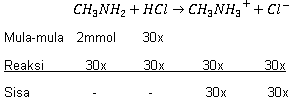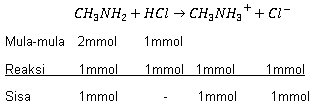Iklan
Pertanyaan
Sebanyak 20 ml larutan metil amina ( CH 3 NH 2 ) 0,1 M dititrasi dengan larutan HCl pH larutan adalah 10 + log 4 dan titik ekuivalen terjadi setelah penambahan 30 ml larutan HCl , maka .... (SBMPTN 2013)
Sebanyak 20 ml larutan metil amina () 0,1 M dititrasi dengan larutan pH larutan adalah 10 + log 4 dan titik ekuivalen terjadi setelah penambahan 30 ml larutan , maka ....
(SBMPTN 2013)
[] = 0,15 M
pada titik ekivalen pH = 7
pada titik ekivalen pH = 4 - log 4
metil amina adalah
metil amina adalah
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
4
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia