Iklan
Pertanyaan
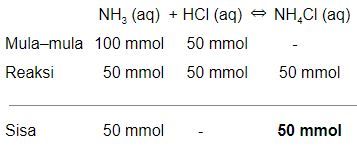
Sebanyak 100 mL NH 3 1 M direaksikan dengan 50 mL HCl 1 M.Jika K b NH 3 = 1 , 8 × 1 0 − 5 dan log 1,8 = 0,25, pada akhir reaksi larutan akan memiliki pH = 9,25 SEBAB larutan tersebut ketika diencerkan sebanyak 10 kali pHnya berkurang 1. Pilihlah:
Sebanyak 100 mL 1 M direaksikan dengan 50 mL HCl 1 M. Jika dan log 1,8 = 0,25, pada akhir reaksi larutan akan memiliki pH = 9,25
larutan tersebut ketika diencerkan sebanyak 10 kali pHnya berkurang 1.
Pilihlah:
pernyataan benar, alasan benar, keduanya ada hubungan sebab akibat
pernyataan benar, alasan benar, keduanya tidak ada hubungan sebab akibat
pernyataan benar dan alasan salah
pernyataan salah dan alasan benar
pernyataan dan alasan, keduanya salah
Iklan
I. Solichah
Master Teacher
1
5.0 (1 rating)
Intan Retno Wulandari
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia