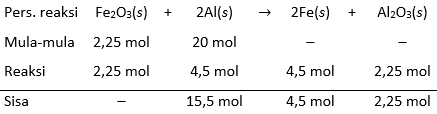Iklan
Pertanyaan
Reaksi antarabesi(III) oksida dengan logam aluminium dikenal sebagai reaksi termit yang diterapkan pada proses pengelasan besi. Kedua zat direaksikandengan perbandingan 2: 3hingga menghasilkan sejumlahbesi danaluminium oksida. Jika massa total kedua reaktan adalah 900 g, perbandingan massa produk yang dihasilkan adalah .... ( A r O = 16, Al = 27, dan Fe = 56)
Reaksi antara besi(III) oksida dengan logam aluminium dikenal sebagai reaksi termit yang diterapkan pada proses pengelasan besi. Kedua zat direaksikan dengan perbandingan 2 : 3 hingga menghasilkan sejumlah besi dan aluminium oksida. Jika massa total kedua reaktan adalah 900 g, perbandingan massa produk yang dihasilkan adalah ....
( O = 16, Al = 27, dan Fe = 56)
25 : 29
26 : 29
56 : 51
56 : 53
51 : 53
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
1
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia