Iklan
Pertanyaan
Proses pembuatan gas NO 2 sesuai dengan reaksi: 2 NO ( g ) + O 2 ( g ) ⇌ 2 NO 2 ( g ) Diperoleh data sebagai berikut. Jika suhu dinaikkan pada tekanan tetap, ternyata harga K p turun menjadi 9 1 kalinya. Sedangkan jika suhu diturunkan kembali, harga K p akan kembali naik. Pernyataan yang tepat mengenai hal tersebut adalah ... . (SOAL STANDAR KISI-KISI SBMPTN 2020)
Proses pembuatan gas sesuai dengan reaksi:
Diperoleh data sebagai berikut.
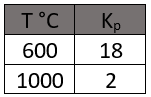
Jika suhu dinaikkan pada tekanan tetap, ternyata harga turun menjadi kalinya. Sedangkan jika suhu diturunkan kembali, harga akan kembali naik. Pernyataan yang tepat mengenai hal tersebut adalah ... .
(SOAL STANDAR KISI-KISI SBMPTN 2020)
Reaksi pembentukan gas adalah reaksi eksotermal, sehingga kenaikan suhu menyebabkan konsentrasi berkurang.
Reaksi pembentukan gas adalah reaksi endotermal sehingga penurunan suhu akan mengubah kompisisi zatnya dalam kesetimbangan.
Saat suhu dinaikkan tekanan parsial gas bertambah, tekanan parsial gas dan bertambah.
Saat suhu diturunkan tekanan parsial gas berkurang, tekanan parsial gas dan bertambah.
Saat suhu diturunkan pada tekanan tetap, tekanan parsial gas : gas
Iklan
N. Puspita
Master Teacher
9
4.7 (16 rating)
Hari Ansa
Pembahasan tidak lengkap
Dini Antika
Mudah dimengerti
Susilowati Dwi
Pembahasan lengkap banget Ini yang aku cari! Makasih ❤️ Mudah dimengerti Bantu banget
Najmiatul Salwa
Makasih ❤️
Alvina Dwi Harminansyah
Pembahasan tidak menjawab soal Pembahasan tidak lengkap Jawaban tidak sesuai Pembahasan terpotong
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia

















