Iklan
Pertanyaan
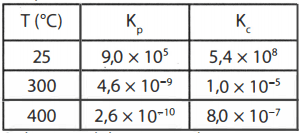
Proses Haber-Bosch merupakan proses pembentukan amonia berdasarkan reaksi: 2 H 2 ( g ) + N 2 ( g ) ⇌ 2 NH 3 ( g ) Data K c dan K p dari reaksi kesetimbangan (dapat balik) tersebut pada berbagai temperatur adalah ... Dalam wadah 1 L terdapat 20 g H 2 , 28 g N 2 , dan sejumlah NH 3 dalam kesetimbangan pada 300 ∘ C . Jika gas NH 3 dalam kesetimbangan tersebut dipisahkan dan dilarutkan dalam 1 L air maka pH larutan yang diperoleh adalah ... ( K b NH 4 OH = 1 0 − 5 )
Proses Haber-Bosch merupakan proses pembentukan amonia berdasarkan reaksi:
Data dan dari reaksi kesetimbangan (dapat balik) tersebut pada berbagai temperatur adalah ...
Dalam wadah 1 L terdapat 20 g , 28 g , dan sejumlah dalam kesetimbangan pada . Jika gas dalam kesetimbangan tersebut dipisahkan dan dilarutkan dalam 1 L air maka pH larutan yang diperoleh adalah ... ()
8
9
10
11
12
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
1
5.0 (3 rating)
AN
Asyiva Naziela
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia