Iklan
Pertanyaan
Perhatikan tabel pengisian elektron-elektron dalam subkulit berikut ini! Pengisian elektron yang benar ditunjukkan oleh unsur ...
Perhatikan tabel pengisian elektron-elektron dalam subkulit berikut ini!
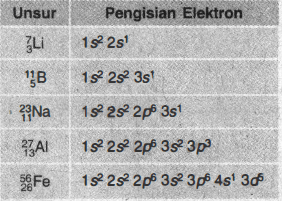
Pengisian elektron yang benar ditunjukkan oleh unsur ...
dan
dan
dan
dan
dan
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
3
4.6 (11 rating)
DM
Deilla Mikha
Mudah dimengerti
Sl
Sel ly
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















