Iklan
Pertanyaan
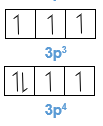
Perhatikan tabel konfigurasi elektron dan harga ionisasi dari beberapa atom unsur periode ketiga dalam sistem periodik unsur (lihat tabel di bawah). Bila ditinjau dari besarnya jari-jari atom, maka sepanjang periode dari kiri ke kanan semakin kecil, tetapi harga energi ionisasinya tidak selalu semakin besar. Misalnya dari Mg ke Al dan P ke S. Mengapa perubahan harga energi ionisasi tidak sejalan dengan perubahan jari-jari atom?
Perhatikan tabel konfigurasi elektron dan harga ionisasi dari beberapa atom unsur periode ketiga dalam sistem periodik unsur (lihat tabel di bawah). Bila ditinjau dari besarnya jari-jari atom, maka sepanjang periode dari kiri ke kanan semakin kecil, tetapi harga energi ionisasinya tidak selalu semakin besar. Misalnya dari Mg ke Al dan P ke S. Mengapa perubahan harga energi ionisasi tidak sejalan dengan perubahan jari-jari atom?
Iklan
S. Lubis
Master Teacher
Mahasiswa/Alumni Universitas Sumatera Utara
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia