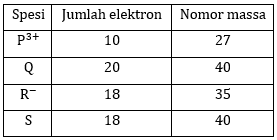
Langkah penyelesaian soal sebagai berikut.
Langkah 1: menentukan jumlah elektron masing-masing spesi
- Ion P3+ terbentuk setelah unsur P melepaskan 3 buah elektronnya. Oleh karena ion P3+ memiliki 10 elektron, unsur P memiliki 10 + 3 = 13 elektron.
- Unsur Q sebagai atom netral memiliki 20 elektron.
- Ion R− terbentuk karena unsur R menerima 1 buah elektron. Oleh karena ion R− mempunyai 18 elektron, unsur R mempunyai 18 − 1 = 17 elektron.
- Unsur S sebagai atom netral mempunyai 18 elektron.
Langkah 2: menentukan konfigurasi elektron letak unsur pada SPU
Unsur P memiliki konfigurasi elektron sebagai berikut.
13P=[10Ne] 3s2 3p1
Unsur P memiliki elektron valensi  sehingga berdasarkan elektron valensi tersebut unsur P terletak pada periode 3 dan golongan IIIA di SPU.
sehingga berdasarkan elektron valensi tersebut unsur P terletak pada periode 3 dan golongan IIIA di SPU.
Konfigurasi elektron unsur Q sebagai berikut.
20Q=[18Ar] 4s2
Unsur Q memiliki elektron valensi  sehingga unsur Q terletak pada periode 4 dan golongan IIA.
sehingga unsur Q terletak pada periode 4 dan golongan IIA.
Konfigurasi elektron unsur R sebagai berikut.
17R=[10Ne] 3s2 3p5
Elektron valensi unsur R adalah  sehingga unsur R terletak pada periode 3 dan golongan VIIA.
sehingga unsur R terletak pada periode 3 dan golongan VIIA.
Konfigurasi elektron unsur S sebagai berikut.
18S=[10Ne] 3s2 3p6
Elektron valensi unsur S adalah  sehingga unsur S terletak pada periode 3 dan golongan VIIIA.
sehingga unsur S terletak pada periode 3 dan golongan VIIIA.
Langkah 3: menganalisis opsi jawaban
- Unsur R dan S bukan merupakan unsur yang sama. Hal ini dibuktikan dengan kedua unsur tersebut terletak pada golongan yang berbeda. (Opsi A salah)
- Unsur P, R, dan S terletak pada periode 3, sedangkan Q terletak pada periode 4. (Opsi B salah)
- Unsur yang memiliki konfigurasi elektron yang paling stabil adalah unsur S yang terletak pada golongan VIIIA (gas mulia). (Opsi C salah)
- Sifat jari-jari atom pada satu periode (kiri ke kanan) makin kecil, sedangkan pada satu golongan (atas ke bawah) makin besar. Urutan jari-jari atom dari yang terkecil hingga terbesar adalah S < R < P < Q. Unsur Q memiliki jari-jari atom terbesar (Opsi D salah) dan jari-jari unsur P lebih kecil daripada unsur Q (opsi E benar).
Jadi, jawaban yang benar adalah E.