Iklan
Pertanyaan
Perhatikan struktur Lewis berikut! Struktur yang paling stabil berdasarkan konsep muatan formal adalah ....(Nomor atom C = 6, N = 7, S = 16)
Perhatikan struktur Lewis berikut!
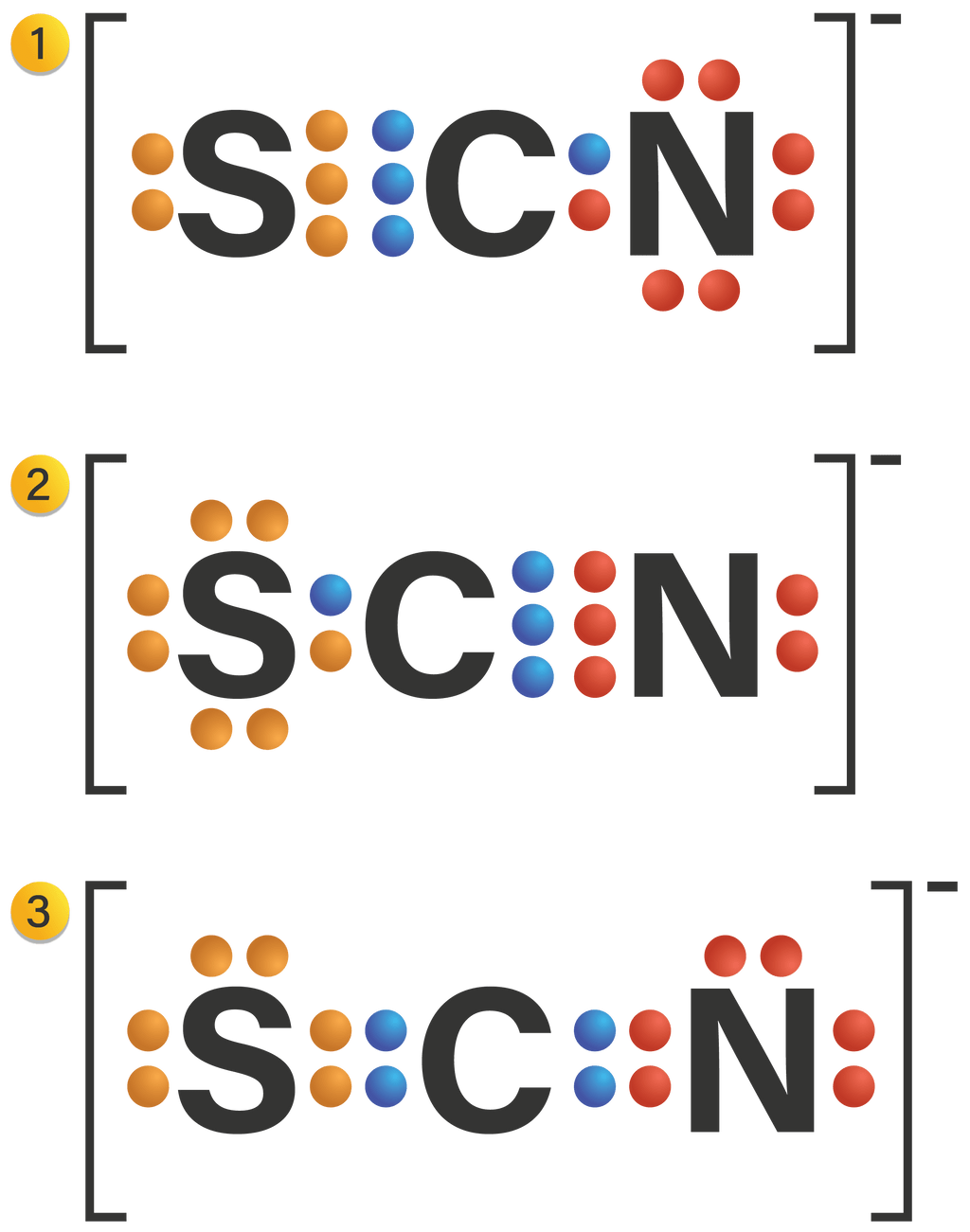
Struktur yang paling stabil berdasarkan konsep muatan formal adalah .... (Nomor atom C = 6, N = 7, S = 16)
1 saja
2 saja
3 saja
1 dan 2
2 dan 3
Iklan
EM
E. Mahardika
Master Teacher
Jawaban terverifikasi
3
1.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















