Iklan
Pertanyaan
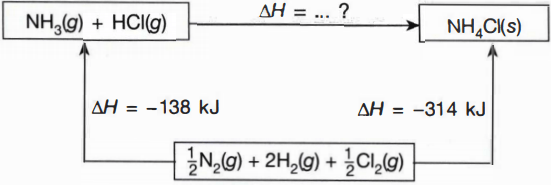
Perhatikan siklus Hess berikut! Dari siklus Hess di atas, hitunglah nilai perubahan entalpi reaksi: NH 3 ( g ) + HCl ( g ) → NH 4 Cl ( s )
Perhatikan siklus Hess berikut!
Dari siklus Hess di atas, hitunglah nilai perubahan entalpi reaksi:
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
79
4.8 (37 rating)
AA
Afza Almuzanni
Pembahasan lengkap banget
FF
Feni Firlya Kusnifa
Pembahasan lengkap banget Ini yang aku cari! Makasih ❤️
HA
Hikmah, A
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
AA
Alya Azriana
Pembahasan lengkap banget
rz
rena zelle
Bantu banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia