Iklan
Pertanyaan
Perhatikan sifat keperiodikan unsur-unsur periode ketiga berikut! Secara umum, makin kecil jari-jari atom suatu unsur maka energi ionisasinya makin besar. Berdasarkan tabel di atas, jelaskan alasan unsur Mg memiliki energi ionisasi lebih besar daripada unsur Al dan unsur P memiliki energi ionisasi lebih besar dari pada S!
Perhatikan sifat keperiodikan unsur-unsur periode ketiga berikut!
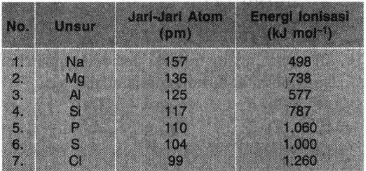
Secara umum, makin kecil jari-jari atom suatu unsur maka energi ionisasinya makin besar. Berdasarkan tabel di atas, jelaskan alasan unsur Mg memiliki energi ionisasi lebih besar daripada unsur Al dan unsur P memiliki energi ionisasi lebih besar dari pada S!
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
3
4.5 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia

















