Iklan
Pertanyaan
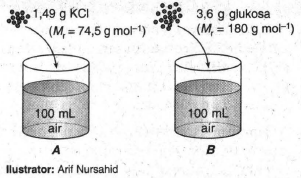
Perhatikan ilustrasi berikut! Beberapa pernyataan tentang kedua larutan tersebut sebagai berikut. Pelarut pada gelas A lebih mudah menguap dibandingkan pelarut pada gelas B. Titik beku larutan A lebih rendah dibandingkan larutan B. Jumlah partikel zat terlarut pada gelas A sama dengan jumlah partikel zat terlarut pada gelas B. Titik didih larutan A lebih tinggi dibandingkan larutan B. Pernyataan yang benar ditunjukkan oleh angka ....
Perhatikan ilustrasi berikut!
Beberapa pernyataan tentang kedua larutan tersebut sebagai berikut.
- Pelarut pada gelas A lebih mudah menguap dibandingkan pelarut pada gelas B.
- Titik beku larutan A lebih rendah dibandingkan larutan B.
- Jumlah partikel zat terlarut pada gelas A sama dengan jumlah partikel zat terlarut pada gelas B.
- Titik didih larutan A lebih tinggi dibandingkan larutan B.
Pernyataan yang benar ditunjukkan oleh angka ....
1 dan 2
1 dan 3
2 dan 3
2 dan 4
3 dan 4
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
2
4.0 (4 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia