Iklan
Pertanyaan
Perhatikan gambar berikut! Tentukan perubahan entalpi reaksi: NaCl ( s ) → Na + ( g ) + Cl − ( g )
Perhatikan gambar berikut!
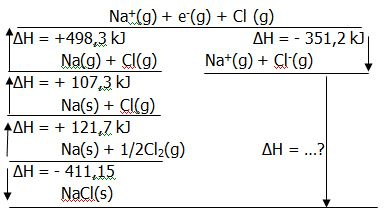
Tentukan perubahan entalpi reaksi:
+35.05 kJ
+787.25 kJ
+182.15 kJ
+640.15 kJ
-35.05 kJ
Iklan
SH
S. Hidayati
Master Teacher
Mahasiswa/Alumni Universitas Indonesia
Jawaban terverifikasi
1
4.0 (3 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















