Iklan
Pertanyaan
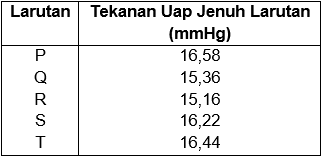
Perhatikan data tekanan uap beberapa larutanpada suhu tertentu berikut! Berdasarkan data tersebut, larutan yang mengandung jumlah partikel zat terlarut nonvolatil paling banyak adalah ....
Perhatikan data tekanan uap beberapa larutan pada suhu tertentu berikut!
Berdasarkan data tersebut, larutan yang mengandung jumlah partikel zat terlarut nonvolatil paling banyak adalah ....
P
Q
R
S
T
Iklan
SL
S. Lubis
Master Teacher
Mahasiswa/Alumni Universitas Sumatera Utara
Jawaban terverifikasi
31
5.0 (5 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia