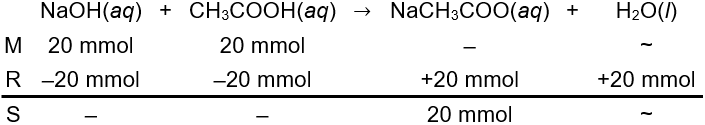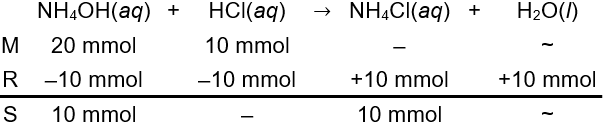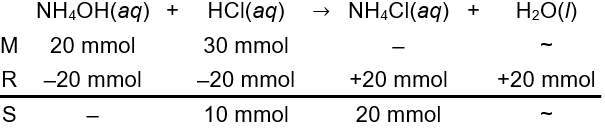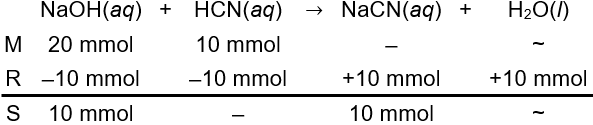Soal tersebut dapat diselesaikan menggunakan konsep pembuatan larutan penyangga. Larutan penyangga dapat dibuat dengan 2 cara, yaitu tanpa reaksi kimia dan melalui reaksi kimia.
- Pembuatan larutan penyangga tanpa reaksi kimia
Larutan penyangga yang bersifat asam dapat dibuat dengan mencampurkan asam lemah dengan garam yang mengandung basa konjugasinya. Contohnya, pencampuran larutan CH3COOH dengan larutan NaCH3COO.
Larutan penyangga yang bersifat basa dapat dibuat dengan mencampurkan basa lemah dengan garam yang mengandung asam konjugasinya. Contohnya, pencampuran larutan NH4OH dengan larutan NH4Cl.
- Pembuatan larutan penyangga melalui reaksi kimia
Larutan penyangga yang bersifat asam dapat dibuat dengan mencampurkan asam lemah dengan basa kuat sehingga keduanya akan bereaksi. Ingat! Asam lemah harus bersisa di akhir reaksi.
Larutan penyangga yang bersifat basa dapat dibuat dengan mencampurkan basa lemah dengan asam kuat sehingga keduanya akan bereaksi. Ingat! Basa lemah harus bersisa di akhir reaksi.
Opsi A
Senyawa NaOH merupakan basa kuat dan senyawa CH3COOH merupakan asam lemah. Keduanya akan bereaksi membentuk garam dan air. Mol keduanya dihitung menggunakan persamaan berikut.
M=Vnn=M×V
Mol masing-masing dapat dihitung sebagai berikut.
n NaOH=M×Vn NaOH=0,2 M×100 mLn NaOH=20 mmoln CH3COOH=M×Vn CH3COOH=0,2 M×100 mLn CH3COOH=20 mmol
Perhitungan stoikiometrisnya adalah sebagai berikut.
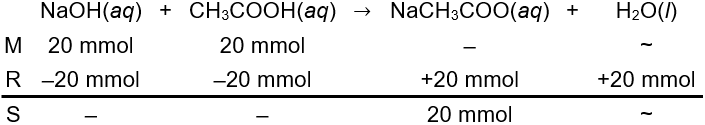
Berdasarkan perhitungan stoikiometris di atas, asam lemah tidak bersisa di akhir reaksi sehingga pencampuran kedua larutan tidak membentuk larutan penyangga (Opsi A salah).
Opsi B
Senyawa NH4OH merupakan basa lemah dan senyawa HCl merupakan asam kuat. Keduanya akan bereaksi membentuk garam dan air. Sama dengan pada opsi A, mol keduanya dihitung sebagai berikut.
n NH4OH=M×Vn NH4OH=0,2 M×100 mLn NH4OH=20 mmoln HCl=M×Vn HCl=0,1 M×100 mLn HCl=10 mmol
Perhitungan stoikiometrisnya adalah sebagai berikut.
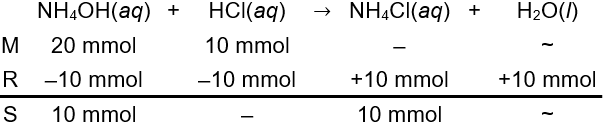
Berdasarkan perhitungan stoikiometris di atas, basa lemah bersisa di akhir reaksi dan terbentuk garam yang mengandung asam konjugat dari basa lemah sehingga pencampuran kedua larutan membentuk larutan penyangga (Opsi B benar).
Opsi C
Larutan yang dicampurkan sama dengan pada opsi B. Mol keduanya dihitung sebagai berikut.
n NH4OH=M×Vn NH4OH=0,2 M×100 mLn NH4OH=20 mmoln HCl=M×Vn HCl=0,3 M×100 mLn HCl=30 mmol
Perhitungan stoikiometrisnya adalah sebagai berikut.
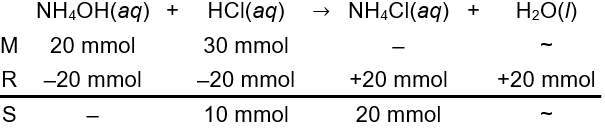
Berdasarkan perhitungan stoikiometris di atas, basa lemah tidak bersisa di akhir reaksi sehingga pencampuran kedua larutan tidak membentuk larutan penyangga (Opsi C salah).
Opsi D
Senyawa NaOH merupakan basa kuat dan senyawa HCN merupakan asam lemah. Keduanya akan bereaksi membentuk garam dan air. Sama dengan pada opsi A, mol keduanya dihitung sebagai berikut.
n NaOH=M×Vn NaOH=0,2 M×100 mLn NaOH=20 mmoln HCN=M×Vn HCN=0,1 M×100 mLn HCN=10 mmol
Perhitungan stoikiometrisnya adalah sebagai berikut.
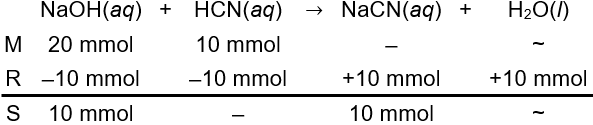
Berdasarkan perhitungan stoikiometris di atas, asam lemah tidak bersisa di akhir reaksi sehingga pencampuran kedua larutan tidak membentuk larutan penyangga (Opsi D salah).
Opsi E
Senyawa NaOH merupakan basa kuat dan senyawa HCl merupakan asam kuat. Pencampuran larutan asam kuat dengan basa kuat tidak membentuk larutan penyangga (Opsi E salah).
Dengan demikian, pasangan larutan yang menghasilkan larutan penyangga ketika dicampur adalah 100 mL NH4OH 0,2 M + 100 mL HCl 0,1 M.
Jadi, jawaban yang benar adalah B.